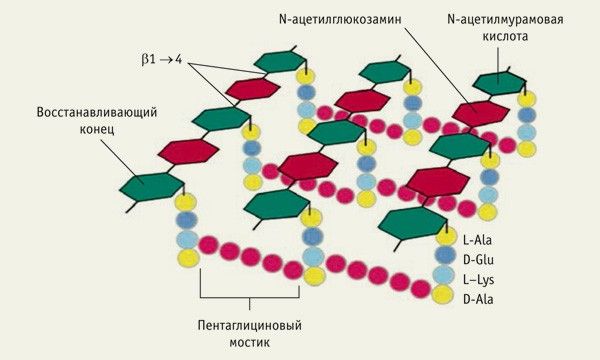
Иммунный ответ на введение живой инкубаторной вакцины МВ-1®
Йосси ВАЙН
Иерусалимский Университет, Израиль
Вирджини ЛЁБ
Адераев АСМАРЭ
Компания Abic Biological Laboratories Ltd., Израиль
Окончание. Начало в №10
В предыдущей части статьи мы начали рассказывать о результатах исследования эффективности введения суточным цыплятам вакцины против болезни Гамборо MB-1® (депротеинизированная аттенуированная живая вакцина) производства компании Abic Biological Laboratories Ltd., Израиль. Возможное взаимодействие между иммунной системой хозяина (антитела) и штаммом вакцинного вируса (MB-1® IBDV) вблизи его основного органа-мишени (бурсы) может пролить свет на динамику процесса иммунизации. Чтобы исследовать это взаимодействие, были проведены исследования методом ИФА, разработанным компанией Abic Biological Laboratories Ltd., Израиль для обнаружения иммунных комплексов IgY-IBDV (VP2) в интерстициальной жидкости бурсы.
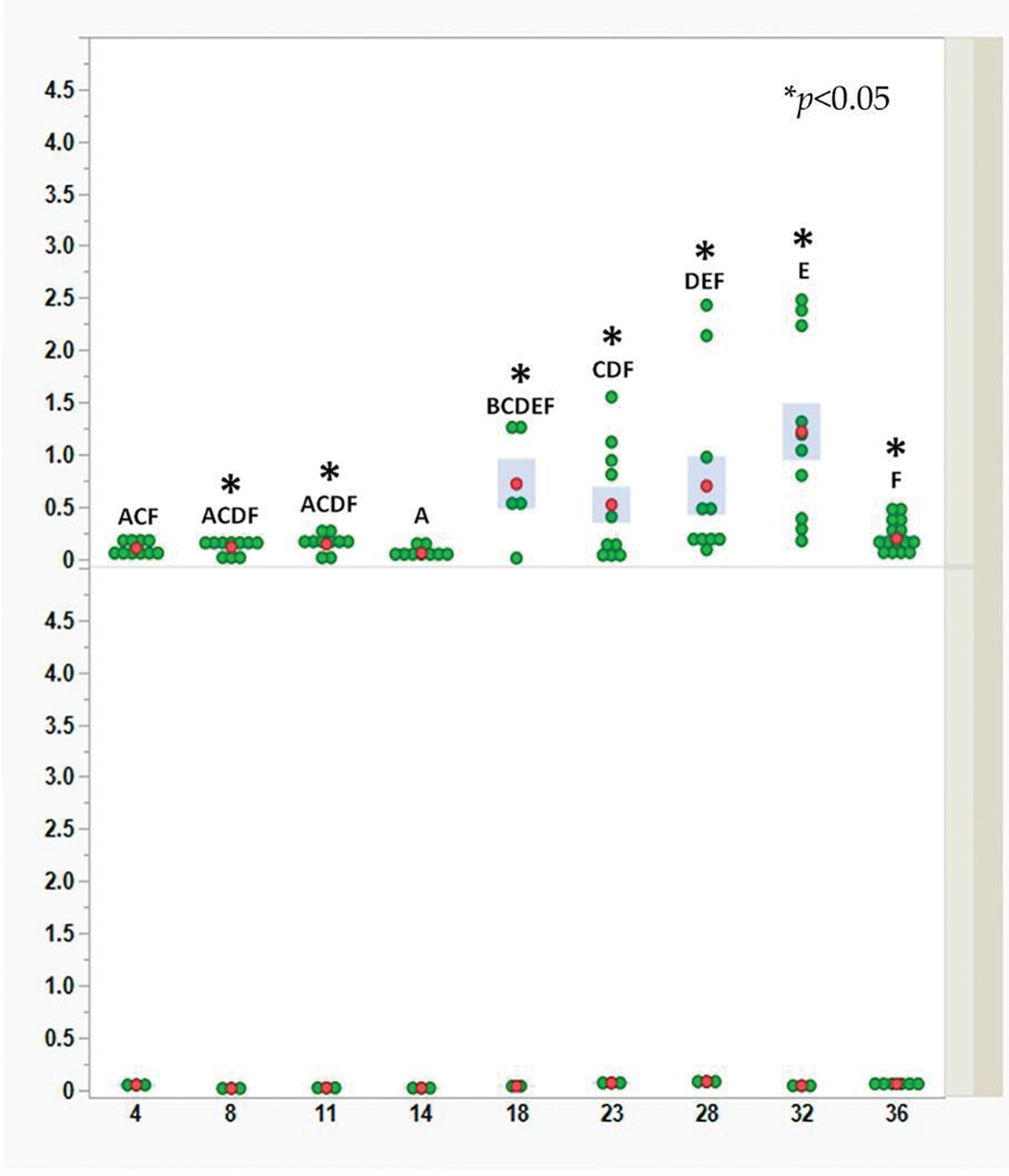
На рисунке 1 видно, что у цыплят контрольной группы иммунные комплексы не были обнаружены (нижняя панель), в то время как у вакцинированной птицы очень низкий уровень иммунных комплексов IgY-IBDV зафиксировали уже на 4‑й день жизни (верхняя панель). Такой показатель сохранялся на протяжении 14 дней. На 18‑й день жизни уровень иммунных комплексов у вакцинированных цыплят повышался.
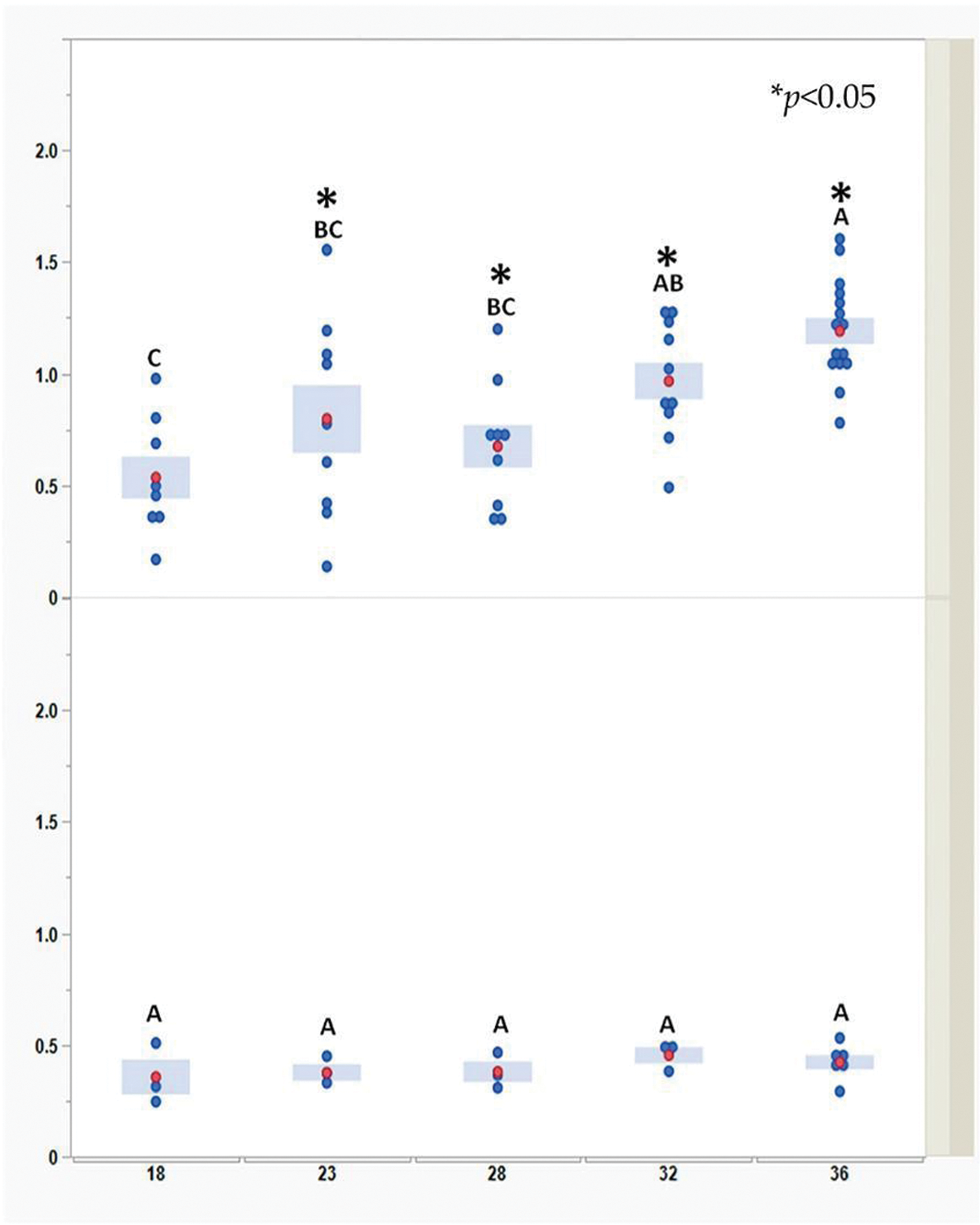
В среднем уровень иммунных комплексов повышался умеренно до достижения бройлерами возраста 32 дней. Резкое снижение уровня иммунных комплексов у всех обследованных цыплят зафиксировали на 36‑й день жизни. Как и в предыдущих исследованиях по определению концентрации вируса IBDV в бурсе, в период с 18‑го по 32‑й день жизни отмечена высокая вариабельность показателей отдельных особей. Таким образом, было показано, что иммунные комплексы, локализованные в интерстициальной ткани бурсы, препятствуют инфицированию В-лимфобластов вакцинным вирусом.
Уровни иммунных комплексов были получены с использованием сэндвич-ИФА, разработанного компанией Abic Biological Laboratories Ltd., Израиль. На рисунке 1 каждая зеленая точка обозначает отдельного цыпленка в конкретный момент времени и в определенной группе. Для каждой временнОй точки и группы красные точки и синие столбцы представляют среднее значение десяти измерений отдельных вакцинированных цыплят и трех измерений трех невакцинированных цыплят (15 измерений — показатели вакцинированных цыплят, 6 измерений — показатели невакцинированных цыплят на 36‑й день жизни). Ввиду неоднородности дисперсии между днями достоверность различий между средними значениями дней определяли с помощью непараметрического критерия Вилкоксона для каждой пары. Показатели, зафиксированные в дни, обозначенные разными сочетаниями букв, достоверно различаются (p < 0,05). Достоверность различий между средними значениями групп в течение каждого дня определяли с помощью t-критерия Уэлча (p < 0,05). Различия отмечены звездочками (см. рис. 1).
Миграция и локализация вакцинного вируса MB-1® в селезенке, а не в бурсе в первые 14 дней жизни (см. рис. 2, панель C, в первой части статьи, опубликованной в № 10) побудили нас определить, присутствуют ли материнские антитела в бурсе и селезенке цыплят из контрольной группы. Уровни антител IgY и IgA к IBDV определяли с помощью ИФА, разработанного компанией Abic Biological Laboratories Ltd., Израиль.
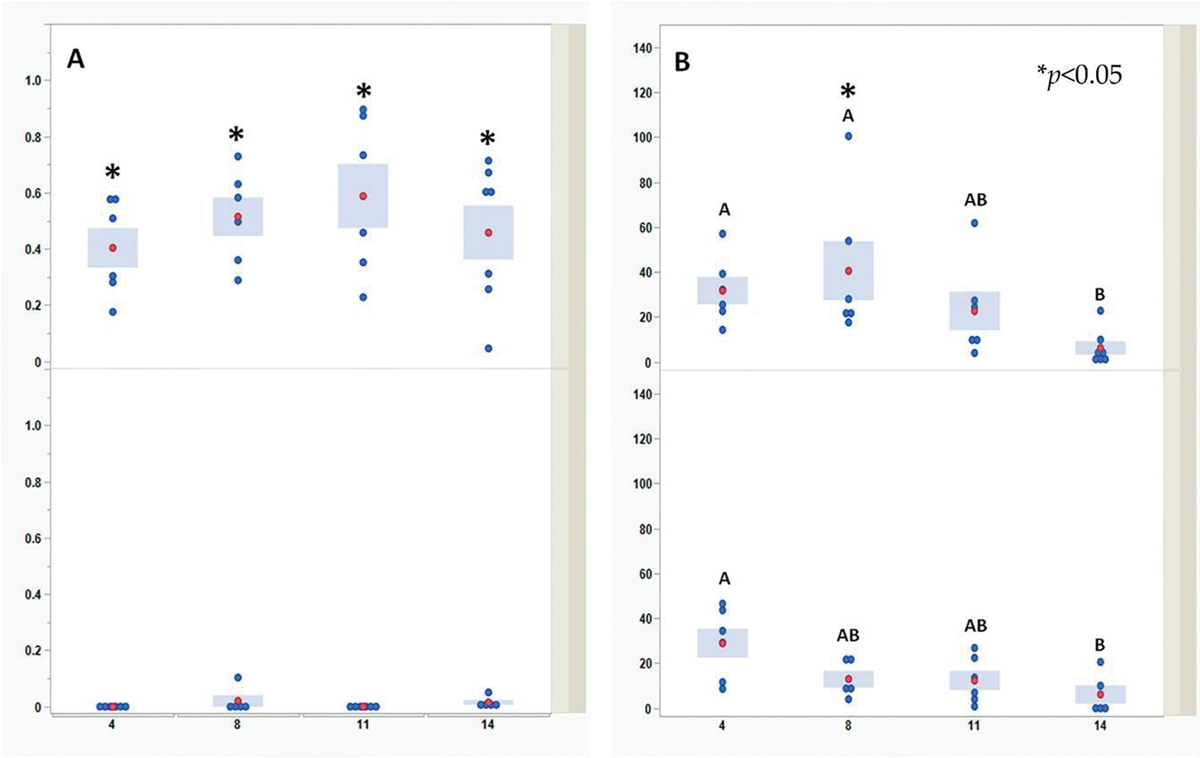
На рисунке 2 (панель А) видно, что в период с 4‑го по 14‑й день жизни уровни антител IgA к IBDV в бурсе значительно превышали аналогичные показатели в селезенке. Уровни антител IgY к IBDV регистрировали как в селезенке, так и в бурсе на 4‑й день (рис. 2, панель B). В бурсе уровни антител IgY к IBDV сохранялись дольше, чем в селезенке (сравнивали уровни антител на 8‑й и 11‑й дни жизни). На 14‑й день жизни уровни антител IgY к IBDV снизились до одинаковых значений в обоих органах.
Уровни IgY и IgA определяли методом непрямого (количественного и качественного соответственно) ИФА, разработанным компанией Abic Biological Laboratories Ltd., Израиль для распознавания VP2 IBDV. На рисунке 2 каждая синяя точка обозначает отдельного цыпленка, а также орган в определенный момент времени. Для каждой временнОй точки и органа красные точки и синие столбцы представляют среднее значение измерений показателей шести отдельных цыплят. При выявлении как IgY, так и IgA к IBDV использовали однофакторную модель ANOVA для определения достоверности различий между средними значениями за день в одном и том же органе. Дни, обозначенные разными сочетаниями букв, достоверно различаются по критерию Тьюки (p < 0,05). Ввиду неоднородности дисперсии между органами в течение суток достоверность различий между средними значениями определяли с помощью t-критерия Уэлча (p < 0,05). Различия отмечены звездочками (см. рис. 2).
Перечисленные выше данные указывают на то, что селезенка является основным органом, в котором локализуется вакцинный вирус MB-1® в период эффективной материнской иммунной защиты в бурсе. Следующим шагом стала характеристика популяций клеток спленоцитов, инфицированных вирусом. Поэтому флуоресцентный сортинг и конфокальную микроскопию проводили на шести пулах суспензий одиночных клеток, приготовленных из образцов селезенок девяти вакцинированных или девяти невакцинированных цыплят. Селезенки отбирали на четвертый день жизни (через три дня после вакцинации вакциной MB-1®). Клетки окрашивали согласно методике, каждый пул исследовали способом флуоресцентной конфокальной микроскопии.
Двойное окрашивание с отрицательным изотипическим контролем (рис. 3, панель А) показывает популяцию одиночных спленоцитов, расположенных исключительно в четвертой четверти диаграммы FACS (95,3 ± 1,4%). Соответственно, на парной микрофотографии видны только клетки с окрашенным DAPI-ядром (рис. 3, панель B). Как и ожидалось, вирусный сигнал не был обнаружен в контрольных пулах. Двойное окрашивание (использовали маркер IBDV и маркер макрофагов KUL-1) образцов, полученных от вакцинированной птицы (рис. 3, панель C), показало, что 57,02% макрофагов были IBDV-положительными (Q2/Q2 + Q3), а 43% клеток, инфицированных IBDV, являлись макрофагами (Q2/Q2 + Q1).
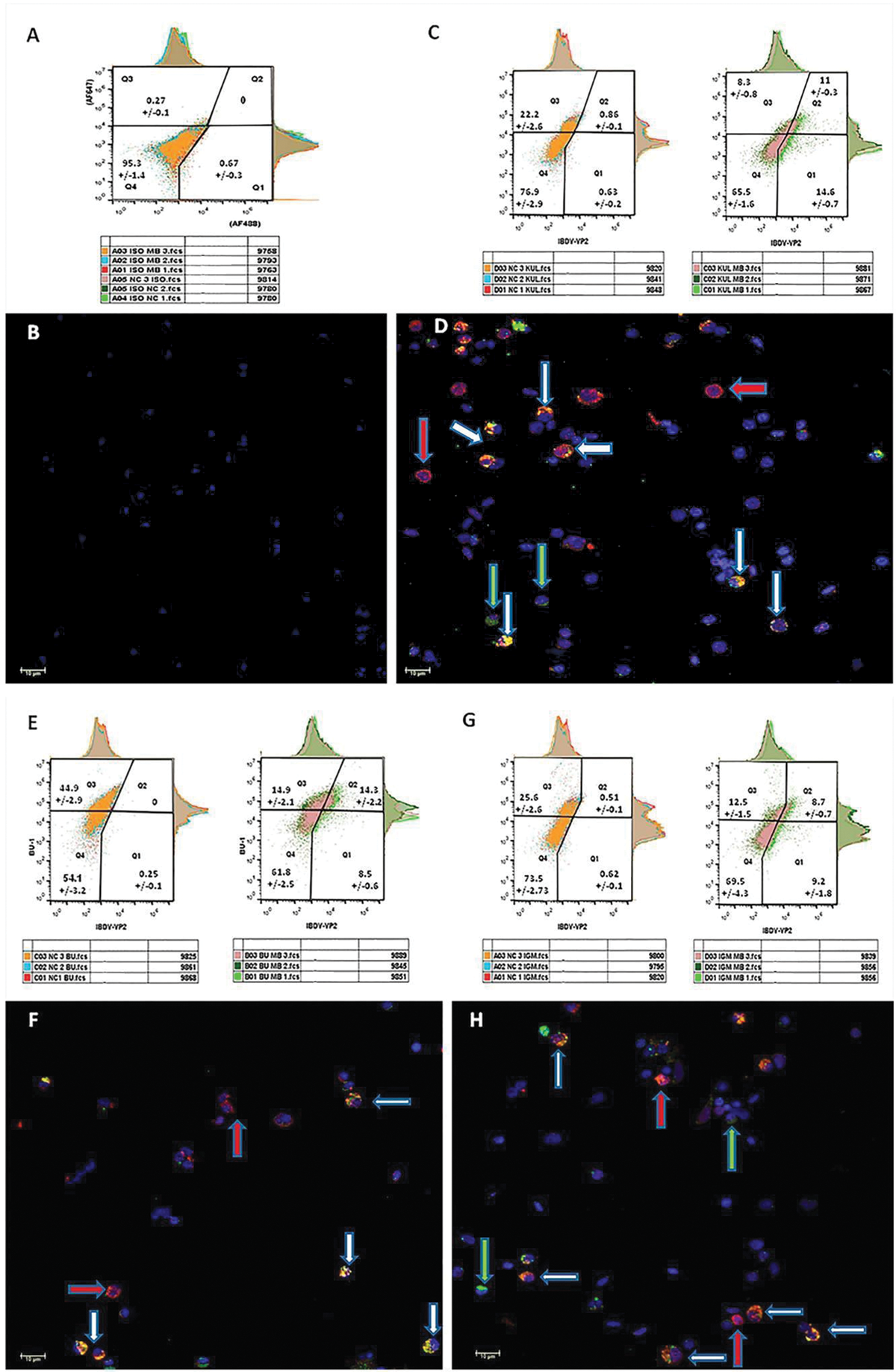
Двойное окрашивание маркером IBDV и маркером B-лимфоцитов BU-1 (рис. 3, панель E) показало, что 48,9% B-лимфоцитов были IBDV-положительными, а 62,3% инфицированных IBDV клеток являлись B-лимфоцитами. Примечательно, что при двойном окрашивании (использовали маркер IBDV и маркер незрелых В-лимфоцитов IgM) вакцинированных образцов (рис. 3, панель G) выявили одинаковую долю незрелых В-клеток (по сравнению с долей В-клеток от общего числа инфицированных IBDV клеток) — 49,3%, хотя вначале считали, что доля инфицированных незрелых В-лимфоцитов составляла около 85%.
На всех микроскопических изображениях вакцинированных MB-1® образцов с двойным окрашиванием (рис. 3: панель D — макрофаги, панель F — В-лимфоциты, панель H — незрелые В-лимфобласты) видны четыре популяции клеток — IBDV-отрицательные клетки (окрашенные только DAPI), IBDV-положительные и отрицательные по клеточным маркерам (синие и зеленые пятна), IBDV-отрицательные и положительные по клеточным маркерам (синие и красные пятна), а также дважды положительные IBDV и положительные по клеточным маркерам (синие, красные и зеленые пятна). Кроме того, фокус-стекинг показал, что клеточные маркеры ограничены клеточными мембранами, в то время как маркер IBDV в основном обнаруживался в цитоплазме клетки.
Пулы суспензии одиночных клеток спленоцитов готовили из девяти селезенок невакцинированных цыплят и девяти селезенок цыплят, привитых вакциной MB-1® в первый день жизни. Образцы были собраны на четвертый день (каждый пул состоял из трех отдельных селезенок, подвергнутых одинаковой обработке). Каждый пул подвергали двойному окрашиванию с использованием моноклонального мышиного антитела AF488 против IBDV-VP2 и антитела AF747 против клеточного маркера макрофагов (см. рис. 3, панель C), B-лимфоцитов (см. рис. 3, панель E) или незрелых B-лимфобластов (см. рис. 3, панель G) и анализировали 10 тыс. клеток в пуле.
Гейтинг проводили с использованием отрицательного по изотипу контроля (см. рис. 3, панель A). Среднее значение, представленное в каждой четверти диаграммы на графиках FACS, составлено из трех пулов (30 тыс. клеток). После FACS-анализа спленоциты из каждого пула (представлены только вакцинированные пулы) дополнительно исследовали под флуоресцентным конфокальным микроскопом.
Изотипический отрицательный контроль (см. рис. 3, панель В) показывает специально промаркированные клетки для исключения ложноположительного фона. Видны четыре возможные популяции клеток — дважды IBVD-отрицательные клетки, окрашенные только синим красителем ядер (DAPI), IBDV-положительные и клеточно-отрицательные по клеточным маркерам, окрашенные синим и зеленым красителями (зеленая стрелка), IBDV-отрицательные и клеточно-положительные по клеточным маркерам, окрашенные синим и красным красителями (красная стрелка) и дважды положительные (IBDV-положительные и клеточно-положительные по клеточным маркерам), окрашенные синим, красным и зеленым красителями (белая стрелка).
Наконец, чтобы выяснить, вызывает ли вакцина MB-1® формирование иммунитета в слизистых оболочках, мы измерили уровни антител IgA к IBDV в желчи в период с 18‑го по 36‑й день жизни. Уровни антител IgA к IBDV (рис. 4) были очень низкими и стабильными у невакцинированных цыплят. В то же время у вакцинированной одновозрастной птицы уровни антител IgA к IBDV оказались положительными на 18‑й день жизни (три цыпленка, отреагировавшие на вакцинацию), а затем повышались вплоть до достижения птицей возраста 36 дней, когда все подопытные секретировали антитела IgA к IBDV в желчь.
Уровни IgA определяли методом непрямого качественного ИФА, разработанного компанией Abic Biological Laboratories Ltd., Израиль для распознавания VP2 IBDV. На рисунке 4 каждая синяя точка обозначает отдельного цыпленка в определенный момент времении в определенной группе. Для каждой временнОй точки и группы красные точки и синие столбцы представляют среднее значение — данные десяти измерений отдельных вакцинированных цыплят и трех измерений трех невакцинированных цыплят (15 измерений вакцинированных и 6 измерений невакцинированных бройлеров на 36‑й день жизни).
Однофакторную модель ANOVA использовали при определении достоверности различий между средними значениями дней в одной и той же группе. Показатели, зафиксированные в дни, обозначенные разными сочетаниями букв, достоверно различаются по критерию Тьюки (p < 0,05). Ввиду неоднородности дисперсии между группами в течение суток достоверность различий между средними значениями органов определяли с помощью t-критерия Уэлча (p < 0,05). Различия отмечены звездочками (см. рис. 4).
Обсуждение
Выработка антител de novo — результат эффективной вакцинации. Вакцина MB-1® отличается от других живых вакцин против IBDV тем, что она обладает двумя характерными особенностями: во‑первых, время сероконверсии зависит от индивидуальных уровней материнских антител к IBDV, во‑вторых, способность вируса к выживанию, несмотря на материнскую защиту, вызывает отсроченную репликацию после индивидуальной иммунизации.
Данные нашего исследования, согласно которому цыплята с низким исходным МАТ (материнские антитела) претерпели раннюю сероконверсию, а цыплята с высоким исходным МАТ подверглись более поздней сероконверсии, согласуются с данными предыдущих исследований (De Wit J., Jorna I., Finger A. et al., 2021). Способность вируса выживать в условиях материнской защиты и в дальнейшем вызывать реакцию антител de novo и формирование иммунитета против IBDV можно лишь частично объяснить наличием разных уровней материнских антител, так как в конечном итоге цыплята с высокими уровнями МАТ также продуцировали эффективный иммунный ответ (Ashash U., Noach C., Perelman B. et al., 2019; Ray S., Ashash U., Muthukumar S. et al., 2021).
Поскольку первичный адаптивный иммунный ответ требовал пролиферации и дифференцирования клеток, а сероконверсия произошла в период с 14‑го по 23‑й день жизни, мы сосредоточились на изучении показателей органов-мишеней в течение трех недель после вылупления, чтобы получить представление о процессе иммунизации бройлеров вакциной MB-1®.
Основным органом-мишенью для IBDV считается бурса (Mahgoub H., Bailey M., Kaiser P., 2012; Qin Y., Zheng S., 2017; Van den Berg T., Eterradossi N., Toquin D. et al., 2000). Поэтому нам было предложено оценить кинетику вирусной нагрузки в бурсе и других органах с помощью количественной ПЦР, как в исследованиях, которые ранее проводили ученые F. Watzinger, К. Ebner K. (2006), J. de Wit, С. Cazaban, R. Dijkman и соавт. (2018), С. Techera, G. Tomas, Y. Panzera и соавт. (2019).
В бурсе вакцинный вирус обнаружили на 14‑й день. Высокую вариабельность концентрации вируса, наблюдавшуюся в период с 18‑го по 28‑й день жизни, можно объяснить различными уровнями материнских антител к IBDV у цыплят и в более поздний срок (примерно на 24‑й день жизни) при появлении антител de novo. Увеличение концентрации вируса на 18‑й день жизни указывает на то, что вакцинный вирус выживал, располагаясь в разных тканях и органах, а не только в бурсе, и перенаправлялся обратно в бурсу при снижении уровня материнского иммунитета. Наконец, снижение концентрации вируса на 36‑й день жизни может свидетельствовать об иммунной нейтрализации de novo.
Известно, что IBDV характеризуется высоким тропизмом к незрелым В-лимфобластам (sIgM+) и обладает способностью обитать в макрофагах (Bülow V., Klasen A., 1983; Inoue M., Yamamoto H., Matuo K., 1992; Ingrao F., Rauw F., Lambrecht B. et al., 2013; Qin Y., Zheng S., 2017; Trapp J., 2022). Исходя из этого, в течение 36 дней после вакцинации изучали кинетику концентрации вируса в первичных и вторичных органах-мишенях IBDV, то есть в бурсе, крови, тимусе и селезенке (Tanimura N., Tsukamoto K., Nakamura K. et al., 1995; Qin Y., Zheng S., 2017; Sharma J.; Kim I., Rautenschlein S., 2000).
Кинетика концентрации вируса в тимусе отличалась от таковой в бурсе. В тимусе вакцинный вирус впервые обнаружили на 23‑й день жизни (на 9 дней позже, чем в бурсе), при этом концентрация вируса была относительно низкой. Кроме того, вирус не выявили в крови. Это может быть обусловлено очень низкой концентрацией незрелых В-лимфобластов (3% от общего числа лимфоцитов) в тимусе (Jeurissen S., Janse E., Ekino S. et al., 1988) и еще меньшим их содержанием в периферической крови (Paramithiotis E., Ratcliffe M., 1993). Примечательно, что вирус MB-1® обнаруживали в селезенке цыплят уже на 4‑й день после вылупления. Количество МВ-1® незначительно увеличивалось до 23‑го дня жизни и, наконец, достигало более высокого значения с 32‑го по 36‑й день. Мы предположили, что селезенка служит «альтернативным» органом-мишенью в период, когда материнский иммунитет наиболее выражен.
Изучение взаимодействия между организмом-хозяином и патогеном вокруг первичного органа-мишени вносит большой вклад в понимание динамики иммунизации бройлеров (Bruni C., Giovenco M., Koch G., Strom R., 1995; Nowak M., Bangham C., 1996; Al-Khalifa H., 2015). Уровень иммунного комплекса IBDV-IgY в интерстициальной жидкости бурсы определяли методом ИФА. Очень низкий уровень иммунных комплексов зарегистрирован в первые две недели жизни, более высокий — в период с 18‑го по 36‑й день жизни. Эти данные коррелировали с данными по кинетике концентрации вируса в селезенке и бурсе.
Можно предположить, что в первые 14 дней жизни концентрация вируса в селезенке была слишком мала для инфицирования клеток бурсы, так как вирусы нейтрализовались материнскими антителами. После снижения их уровня вирус MB-1® мог инфицировать птицу и реплицироваться в клетках бурсы, создавая значительную концентрацию вируса и повышая концентрацию комплексов IBDV-IgY.
Наконец, резкое снижение уровня иммунных комплексов на 36‑й день жизни наряду с уменьшением концентрации вируса в селезенке и бурсе объясняется иммунным ответом антител de novo, уничтожающих вирус. Отмечено, что с 4‑го по 14‑й день в крови иммунные комплексы выявлены не были.
Эффективность материнской защиты — важный фактор, определяющий способность вируса поражать органы. Более того, высокие уровни антител IgA и IgY к IBDV в бурсе свидетельствуют о том, что материнская защита в бурсе была лучше, чем в селезенке. Ученые объясняют это тем, что бурса — орган слизистой оболочки, находящийся под защитой выраженного мукозального иммунитета (Friedman A., Bar-Shira E., Sklan D., 2003; Smith A., Beal R., 2022). К тому же бурса анатомически (через бурсальный проток) связана с пищеварительной системой, что обеспечивает доступ полученных из желточного мешка и вымытых из пищеварительного тракта в бурсу неабсорбированных и интактных материнских антител IgY, нейтрализующих патогены (Kowalczyk K., Daiss J., Halpern J., Roth T., 1985; Hamal K., Burgess S., Pevzner I., Erf G., 2006).
Результаты нашего исследования по материнской защите и нейтрализации патогена в пищеварительном тракте согласуются с результатами проведенных ранее исследований, в ходе которых было установлено, что МАТ может нейтрализовать любую вакцину против IBDV, введенную перорально до 10–17‑го дня жизни (Ashash U., Noach C., Perelman B. et al., 2019; De Wit J., Jorna I., Finger A. et al., 2021).
Полученные нами данные свидетельствуют о том, что селезенка является основным органом для альтернативной передачи вируса вакцины MB-1® на протяжении первых двух недель после вылупления. Это позволило охарактеризовать различные субпопуляции инфицированных спленоцитов. В качестве конечной временнОй точки была выбрана точка «4‑й день жизни» (через три дня после иммунизации вакциной MB-1®), поскольку она представляла собой наиболее раннюю временнУю точку, когда в селезенке регистрировали наличие вируса и фиксировали максимальные уровни МАТ.
Данные проточной цитометрии, подтвержденные данными конфокальной микроскопии, показали, что инфицированная MB-1® клеточная популяция состоит преимущественно из макрофагов. Большее количество макрофагов было IBDV-положительным (примерно 60%) с усиленным флуоресцентным сигналом на клетку, меньшее их количество оказалось B-лимфобластами.
Способность вируса выживать и распространяться в макрофагах была доказана ранее (Inoue M., Yamamoto H., Matuo K., 1992; Tanimura N., Tsukamoto K., Nakamura K. et al., 1995). У птиц селезенка — аналог лимфатических узлов млекопитающих. Орган представляет собой компартментализованное микроокружение, где повышается вероятность взаимодействия антигена с макрофагами и лимфоцитами (процессинг и презентация антигена) для инициации адаптивного иммунного ответа. Кроме того, было установлено, что селезенка является основным органом для хоминга (способность клеток находить «свое место» в организме) макрофагов после фагоцитоза (Nagy Z., Horvath E., Urban Z., 1973; Jeurissen S., 1991; John J., 1994; Scanes C., 2020).
Изучив полученные данные, мы предположили, что IBDV-положительные макрофаги мигрируют в селезенку из эпидермальной ткани (после введения вакцины путем инъекции макрофаги поглощают вакцинный вирус и мигрируют в селезенку). Способность вируса сохранять жизнеспособность в макрофагах — ключевой фактор механизма действия MB-1®, обеспечивающего жизнеспособность вируса в период действия материнского иммунитета.
Решающее значение имеет способность вакцины MB-1® вызывать как мукозальный (IgA), так и гуморальный (нейтрализующий IgY) иммунитет. Мукозальный иммунитет служит первой линией защиты (предотвращает инфицирование), а гуморальный — второй линией защиты (ограничивает время инфицирования и, следовательно, улучшает прогноз).
Выводы
На основе результатов исследования установлен четкий механизм иммунизации вакциной MB-1®. После инъекции вакцинный вирус MB-1®, переносимый эпидермальными макрофагами, мигрирует по кровеносному руслу в селезенку и инфицирует ее. Вирус выживает в селезеночных макрофагах. Распад МАТ обеспечивает распространение, инвазию и репликацию вакцинного вируса MB-1® в органах-мишенях. Наконец, выработка антител IgY к IBDV de novo способствует полной иммунизации бройлеров и уничтожает вирус IBD. Такой принцип действия дает четкое объяснение способности вакцины против вируса MB-1® выживать в организме цыплят при наличии материнского иммунитета и реплицироваться. Все это позволяет проводить эффективную раннюю и непрерывную вакцинацию бройлеров против ИББ.
В исследовании и написании статьи принимали участие Саар Тал (Saar Tal), Авнер Фингер (Avner Finger, Phibro Animal Health Corporation, Израиль) и Аарон Фридман (Aharon Friedman, Иерусалимский Университет, Израиль).
Статья была опубликована в журнале «Вакцины» в августе 2023 г.
Abic Biological Laboratories Ltd., Израиль
www.pahc.com
www.abiksepta.ru