Иммунный ответ на введение живой инкубаторной вакцины МВ-1®
Йосси ВАЙН
Иерусалимский Университет, Израиль
Вирджини ЛЁБ
Адераев АСМАРЭ
Компания Abic Biological Laboratories Ltd., Израиль
Болезнь Гамборо (ИББ) — высококонтагиозное, устойчивое к воздействию внешней среды вирусное заболевание цыплят — может приводить к подавлению иммунитета и развитию вторичных инфекций, сопровождающихся смертностью. Возбудитель болезни — вирус инфекционного бурсита (Infectious bursal disease virus, IBDV) — двухцепочечный РНК-вирус, не покрытый оболочкой, с икосаэдрической симметрией размером 60 нм из рода Avibirnavirus семейства Birnaviridae. Основной путь заражения — пероральный и (или) клоакальный. IBDV представляет серьезную угрозу для птицеводческой отрасли, а значит, особое внимание необходимо уделять иммунизации.
Опасность инфицирования IBDV
Вакцинация бройлеров против ИББ — эффективная стратегия защиты поголовья от клинической формы заболевания (Van den Berg T., Eterradossi N., Toquin D. et al., 2000; Ingrao F., Rauw F., Lambrecht B. et al., 2013; De Wit J., Cazaban C., Dijkman R., 2018). Белок вируса IBDV 2 (VP2 — один из пяти основных белков вируса IBDV) наряду с белком VP3 выполняет функцию вирусного капсидного белка. Как уникальный вирусный белок, выделяемый на поверхности вируса, VP2 играет важную роль в выработке нейтрализующих антител (Van den Berg T., Eterradossi N., Toquin D. et al., 2000; Ingrao F., Rauw F., Lambrecht B. et al., 2013; Mertens J., Casado S., Mata C. et al., 2015; Qin Y., Zheng S., 2017).
Благодаря высокому тропизму к незрелым В-лимфобластам (поверхностные IgM-положительные В-лимфобласты sIgM+) основным органом-мишенью для IBDV служит бурса цыплят в возрасте 1–6 недель (Inoue M., Yamamoto H., Matuo K. et al., 1992; Luo J., Zhang H., Teng M. et al., 2010; Qin Y., Zheng S., 2017; Trapp J., Rautenschlein S., 2022). Мишенью для IBDV могут быть и другие лимфатические органы, такие как селезенка, тимус и скопления лимфоидной ткани в расширенной части стенки слепой кишки, которые считаются вторичными органами-мишенями (Tanimura N., Tsukamoto K., Nakamura K. et al., 1995; Van den Berg T., Eterradossi N., Toquin D. et al., 2000; Ingrao F., Rauw F., Lambrecht B. et al., 2013). Недавно было доказано, что IBDV может обитать в макрофагах (Qin Y., Zheng S., 2017; Trapp J., Rautenschlein S., 2022).
Клиническая картина заболевания вирусным бурситом зависит от количества незрелых В-лимфобластов и, как предполагают ученые, от возраста. Заражение птицы в раннем возрасте (до трех недель) проявляется в виде невысокой смертности и постоянной иммуносупрессии. При заражении в поздние сроки (в возрасте 3–6 недель) отмечают высокую смертность, сопровождаемую преходящей иммуносупрессией (Qin Y., Zheng S., 2017; Ingrao F., Rauw F., Lambrecht B. et al., 2013; Van den Berg T., Eterradossi N., Toquin D. et al., 2000).
В течение многих лет специалисты разрабатывали и проверяли на практике различные стратегии вакцинации — использование живых аттенуированных, инактивированных, субъединичных, векторных (рекомбинантных) и иммуннокомплексных вакцин. Неудивительно, что у каждой из перечисленных стратегий есть свои плюсы и минусы, например, эффективность по сравнению с безопасностью, нейтрализация вакцинного вируса материнскими антителами (МАТ) по сравнению со снижением эффективности материнского иммунитета, начало формирования иммунитета по сравнению с его продолжительностью и, наконец, способность вызывать как гуморальный, так и клеточный иммунный ответ (Spackman E., Pantin-Jackwood M., 2014; Ashash U., Noach C., Perelman B. et al., 2019; De Wit J., Jorna I., Finger A. et al., 2021; Ray S., Ashash U., Muthukumar S. et al., 2021).
Установлено, что живая аттенуированная вакцина имитирует инфицирование, вызванное вирусом полевого штамма, обеспечивает наилучшую защиту организма птицы за счет активации как клеточного, так и гуморального ответа (Van den Berg T., Eterradossi N., Toquin D. et al., 2000; Lazarus D., Pasmanik-Chor M., Gutter B. et al., 2008; Ingrao F., Rauw F., Lambrecht B. et al., 2013; Spackman E., Pantin-Jackwood M., 2014; Ashash U., Noach C., Perelman B. et al., 2019). Поскольку вирус поражает цыплят, эффективная вакцина против IBDV должна обеспечивать раннее начало иммунизации и непрерывную защиту, особенно бройлеров, у которых период выработки активного иммунитета после разрушения материнских антител весьма непродолжителен (Van den Berg T., Eterradossi N., Toquin D. et al., 2000; Ingrao F., Rauw F., Lambrecht B. et al., 2013; Ashash U., Noach C., Perelman B. et al., 2019; De Wit J., Jorna I., Finger A. et al., 2021; Ray S., Ashash U., Muthukumar S. et al., 2021).
Вакцину MB-1® (депротеинизированная аттенуированная живая вакцина) производства компании Abic Biological Laboratories Ltd., Израиль, предназначенную для использования в инкубаторах, вводят методом in ovo или подкожно суточным цыплятам. Вакцина безопасна и эффективна. Зарегистрирована во многих странах. Ученые U. Ashash, С. Noach, В. Perelman, I. Jorna, А. Finger, S. Ray, S. Muthukumar и соавт. сообщают о том, что иммунизация птицы вакциной MB-1® приводит к выработке антител против IBDV уже на 23 день.
В многочисленных исследованиях описано взаимодействие материнских антител с вакцинами, которые вводят суточным цыплятам (Niewiesk S., 2014; Deka P., Das S., 2020). Полученные нами и другими исследователями результаты показали, что у отдельных иммунизированных вакциной MB-1® цыплят репликация вируса в бурсе задерживается в зависимости от уровня МАТ в организме (Ashash U., Noach C., Perelman B. et al., 2019; De Wit J., Jorna I., Finger A. et al., 2021; Ashash U., Muthukumar S. et al., 2021). У SPF цыплят (свободных от специфических патогенных контаминантов) этот эффект не проявлялся, а репликация вируса в бурсе начиналась уже через 24 часа после вакцинации (Gagic M., St-Hill C., Sharma J., 1999; Giambrone J., Dormitorio T., Brown T., 2001; Corley M., Giambrone J., 2009; Ashash U., Noach C., Perelman B. et al., 2019; Rosenzweig E., Perelman B., Ashash U., Loeb V., 2019; De Wit J., Jorna I., Finger A. et al., 2021).
Возможное взаимодействие между вакциной MB-1®, материнскими антителами и тропизмом вируса ученые изучали в соответствии со следующей гипотезой.
После введения вирус вакцины MB-1® инфицирует макрофаги, которые затем мигрируют по кровеносному руслу в органы, богатые В-лимфобластами. МАТ препятствуют пролиферации макрофагов.
Уровень МАТ в разных тканях и органах варьирует. Органы, где уровень МАТ низкий, более восприимчивы к инфекции, что позволяет сохранить жизнеспособность вакцинного вируса.
Разрушение системной материнской защиты дает возможность вакцинному вирусу инфицировать все ранее недоступные ткани и органы. Когда уровень заражения становится критическим, формируется защитный иммунный ответ, приводящий к гибели вакцинного вируса.
Бройлеров породы «Росс 308» выращивали в изоляторах с контролируемой средой в экспериментальной лаборатории «Херут» (Израиль). В соответствии со стандартным протоколом (отдел птицеводства Министерства сельского хозяйства Израиля) цыплят кормили полнорационным комбикормом. Воду птица получала вволю. Световой режим — 16 часов света и 8 часов темноты. Температуру воздуха поддерживали с учетом возраста цыплят. Температура воздуха была одинаковой в помещениях, где содержали особей контрольной и опытной групп.
Исследование проводили по протоколу, одобренному государственным комитетом по уходу и использованию животных Министерства здравоохранения — Советом по экспериментам на животных согласно правилам гуманного обращения с животными (Утверждение № IL-20‑6‑226).
Вакцинация вакциной MB-1®
Сразу же после вылупления 161 цыпленка рандомно пометили и разделили на две группы: опытную (113 голов) и контрольную (48 голов). В опытной группе птицу прививали подкожно одной дозой вакцины MB-1® в соответствии с инструкцией производителя (Abic Biological Laboratories Ltd., Израиль). Цыплятам контрольной группы вводили буферный раствор лактата Рингера (Teva Medical LTD, Ашдод, Израиль), используемый в качестве разбавителя для вакцины.
Отбор проб органов и крови
Для определения времени сероконверсии брали кровь у 18 цыплят (одни и те же цыплята в каждой временнОй точке). Для определения динамики вирусной нагрузки, содержания антител и уровня иммунных комплексов в органах брали кровь у 125 цыплят. В каждой временнОй точке (на 4‑й, 8‑й, 11‑й, 14‑й, 18‑й, 23‑й, 28‑й, 32‑й и 36‑й день жизни) использовали разных цыплят из‑за их умерщвления для отбора проб органов. Для отбора проб бурсы, селезенки, тимуса и желчи в указанные дни были умерщвлены 10 цыплят из опытной и 3 цыпленка из контрольной группы, а на 36‑й день — 15 цыплят из опытной и 6 цыплят из контрольной группы.
Чтобы обеспечить достаточную статистическую достоверность при минимальном использовании цыплят, определение необходимого количества подопытных проводили с учетом результатов исследований, опубликованных ранее (Ashash U., Noach C., Perelman B. et al., 2019; Rosenzweig E., Perelman B., Ashash U., Loeb V., 2019; De Wit J., Jorna I., Finger A. et al., 2021., Ashash U., Muthukumar S. et al., 2021), и после консультации со специалистом в области статистики — доктором Йотва Лави.
Было определено количество цыплят для получения значимых результатов (α = 0,05) при достоверности исследования не менее 0,8. Предварительные данные включали аналогичные двухсторонние дизайны дисперсионного анализа (АNOVA), которые мы применяли ранее.
В те же сроки с дополнительной временнОй точкой в суточном возрасте (перед вакцинацией) провели отбор проб крови у девяти вакцинированных и девяти невакцинированных цыплят. В изоляторе выбирали птицу рандомно вручную, удерживали ее и брали по 1,5 мл крови из кожно-локтевой вены. Полученную кровь делили на две части и помещали в пробирки. Кровь из первой пробирки, содержащей TRI Reagent®-BD (Molecular Research Center Inc., Цинциннати, штат Огайо, США), предназначалась для выделения вирусной РНК и дальнейшего количественного определения вирусной нагрузки. Кровь из второй пробирки, содержащей активатор свертывания Vacuette® Z Serum Sep (Greiner Bio-one, Кремсмюнстер, Австрия), предназначалась для подготовки сыворотки и проведения серологических исследований методом ИФА.
Для сортировки клеток методом активированной флуоресценции и конфокальной микроскопии на четвертый день жизни были дополнительно умерщвлены девять вакцинированных и девять невакцинированных цыплят. Пробы селезенки отбирали в пробирку со средой RPMI 1640 с HEPES 25 ммоль и L-глютамином (Biological Industries, Израиль).
Выделение РНК и ПЦР-анализ
Пробы бурсы, селезенки и тимуса каждого цыпленка гомогенизировали раздельно с помощью политрона PT2500E (Kinematica, Швейцария). Затем экстракт центрифугировали при 400 g в течение 10 минут при температуре 4 °С и из супернатанта выделяли РНК с помощью мини-набора для выделения вирусной РНК QIAamp в соответствии с инструкцией производителя (Qiagen, Германия).
Кроме того, РНК выделяли из лимфоцитов периферической крови (PBL) цыплят с помощью TRI Reagent™ (Molecular Research Center, Inc., США). Затем проводили обратную транскрипцию 300 нг РНК из каждого образца и амплификацию комплементарной ДНК (кДНК) с использованием qScript XLT 1‑Step RT-qPCR ToughMix (QuantaBio, США) и специфических праймеров и зондов для генов сегмента А IBDV-MB-1®.
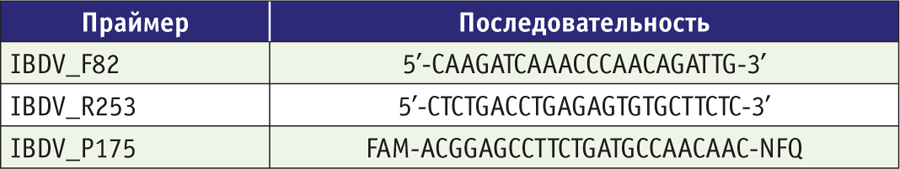
Последовательности праймеров и зондов были сконструированы с помощью программы анализа праймеров Oligo (Molecular Biology Insights, Inc., США) согласно опубликованной в GeneBank последовательности (таблица).
Для определения оптимальной температуры реакции и концентрации кДНК выполняли калибровку пар праймеров и зондов. Уровни экспрессии исследуемых генов определяли методом количественной ПЦР (кПЦР) с использованием термоциклера C1000. Результаты анализировали с помощью программного обеспечения CFX manager™ (www.biorad.com/webroot/web/pdf/lsr/literature/10021337.pdf, дата обращения — 1 июня 2023 г.) компании Bio-Rad (США). Вирусную нагрузку определяли, сравнивая значения Cq со стандартной кривой, построенной по результатам использования вакцины MB-1® с известным титром.
Определение уровня антител
Уровни антител IgY к IBDV определяли в образцах сыворотки крови при помощи теста EISA IBD-XR Ab (IDEXX Laboratories, Inc., США) согласно инструкции производителя. Уровень антител IgY и IgA к вирусу IBDV в органах и желчных жидкостях определяли методом количественного и качественного непрямого ИФА соответственно.
В ходе обоих анализов рекомбинантный IBDV-VP2 (Abic Biological Laboratories Ltd., Израиль) наносили на планшеты для ИФА Nunc (Thermo Fischer Scientific Inc., США), разбавляя в карбонатно-бикарбонатном буфере. Покрытые пластины инкубировали в увлажненной камере при температуре 4 °C в течение ночи, а затем блокировали с помощью 0,5%-го обезжиренного молока BD (Difco, США) в фосфатно-буферном растворе. После тщательной промывки планшета (использовали промывочный раствор Kirkegaard and Perry Laboratories, США) добавляли разбавленные образцы супернатанта из экстрактов органов, предварительно отцентрифугированных при 6000 × g в течение десяти минут при комнатной температуре.
Параллельно с этим для количественного анализа IgY использовали стандартную кривую собственного аффинно очищенного антитела IgY к IBDV-VP2. Затем планшеты снова помещали в увлажненную камеру при температуре 4 °C на всю ночь. Детектирование проводили с использованием Fc-специфичных HRP-конъюгированных поликлональных козьих антител к IgY цыплят или α-цепь-специфичных поликлональных козьих антител IgA цыплят (Bethyl Laboratories, США), субстрата TMB (Kirkegaard and Perry Laboratories, США) и стоп-реагента 450 нм для субстрата TMB (Abcam, Великобритания).
Оптическую плотность определяли при 450 нм с помощью микропланшета-ридера Bio Tek (Bio Tek, США). Количественное определение уровня антител IgY к IBDV проводили путем сравнения значений оптической плотности со стандартной кривой, а уровень антител IgA к IBDV определяли качественно.
Выявление иммунных комплексов IgY-IBDV в органах
ИФА-планшеты покрывали 2,5 мкг/мл моноклонального мышиного антитела IgG к IBDV-VP2 (Abnova, Тайвань), разведенного в карбонатно-бикарбонатном буфере. Покрытые планшеты инкубировали в течение ночи при температуре 4 °C, затем промывали и блокировали, как описано выше. Добавляли подготовленные образцы органов и инкубировали планшеты в течение ночи в увлажненной камере при температуре 4 °C.
Иммунные комплексы IgY-IBDV выявляли с помощью FC-специфического HRP-конъюгированного поликлонального козьего антитела IgY (Bethyl Laboratories, США). Для определения специфичности планшеты инкубировали либо с рекомбинантным IBDV-VP2, добавленным в дозе 50 мкг/мл (Abic Biological Laboratories Ltd., Израиль), либо с контрольными образцами.
Определение локализации IBDV-MB-1® в спленоцитах
Свежие селезенки, полученные от девяти вакцинированных и девяти невакцинированных цыплят, помещали в пробирки со средой RPMI 1640 с HEPES 25 ммоль и L-глютамином (Biological Industries, Израиль) и измельчали с помощью плоского конца плунжера объемом 5 мл и металлической сетки для клеточных культур. Затем суспензию отдельных клеток переносили через нейлоновый фильтр для клеток Falcon™ с размером ячеек 40 мкм (Thermo-Fisher Scientific, США) в свежие конические пробирки вместимостью 50 мл.
Жизнеспособность клеток оценивали на уровне ~95% после окрашивания 0,5%-м трипановым синим (Biological Industries, Израиль). Затем в каждой опытной группе отобрали по три образца, объединив их в один (всего по три объединенных образца от опытной и контрольной групп). Объединение в пул было выполнено из‑за небольшого размера селезенки цыпленка и для обеспечения достаточного выхода клеток для флуоресцентно-активированной сортировки клеток (FACS).
Данные, полученные в результате предварительных экспериментов, свидетельствуют о том, что объединение трех селезенок обеспечивает достаточный выход клеток с минимальной вариабельностью между образцами. Используя 1,6%-й формальдегид (Sigma-Aldrich, США), фиксировали спленоциты в течение 10 минут в фосфатно-буферном растворе, после чего, применяя 0,2%-й Твин 20 (Sigma-Aldrich, США), пермеабилизировали в течение 15 минут в фосфатно-буферном растворе.
Клетки (1 × 106 клеток в пробирке) дважды окрашивали для выявления вирусов и определения субпопуляций спленоцитов — В-лимфоцитов, незрелых В-лимфобластов и макрофагов. Выявление вируса MB-1® IBDV выполняли с использованием моноклонального мышиного IgG против IBDV-VP2 (Abnova, Тайвань), конъюгированного с AF488 при помощи набора для конъюгации антител Lynx Rapid Plus DyLight®488 (Bio-Rad, США) в соответствии с инструкциями производителей.
Субпопуляции спленоцитов определяли с использованием конъюгированных с AF647 моноклональных мышиных антител с применением цветовой маркировки: BU-1 — для В-лимфоцитов, IgM — для незрелых В-лимфобластов и KUL1 — для макрофагов (SouthernBiotech, США). Предварительные эксперименты не показали влияния на дисперсию клеточной популяции после процедур фиксации и пермеабилизации. В качестве внутренних негативных контролей использовали изотипические контроли AF488 IgG и AF647 IgG (SouthernBiotech, США).
Конъюгированные антитела IgG к IBDV-VP2 и AF647, а также конъюгированные анти-BU-1, IgM или KUL1 добавляли к каждому пулу спленоцитов в 1%-м фосфатно-буферном растворе (BSA, Sigma-Aldrich, США) и инкубировали при температуре 4 °С в течение ночи. Затем клетки тщательно промывали и фильтровали через нейлоновый фильтр с диаметром пор 40 мкм для клеток Falcon™ (Thermo-Fisher Scientific, США) в полистироловые пробирки Falcon™ FACS (Becton Dickinson, США). Пробирка с изотипическим контролем служила негативным контролем. В целом было подсчитано 10 тыс. клеток каждого пула, и анализ был выполнен с использованием характеристик анализатора клеток BD Accuri C6 plus с передним и боковым рассеиванием, а также характеристик FL-1 и FL-4.
Анализ методом флуоресцентной конфокальной микроскопии
После окрашивания и анализа FACS клетки из каждого пула наносили на положительно заряженные предметные стекла микроскопа и контрастировали Fluoroshield™ с DAPI (Sigma-Aldrich, США). Снимки делали при помощи конфокального микроскопа SP8 Lightning (Leica, Германия).
Статистический анализ
Статистический анализ проводили с использованием программного обеспечения JMP® (SAS® Institute Inc., США). Для данных с одинаковой дисперсией основные эффекты были проанализированы методом однофакторного или двухфакторного дисперсионного анализа согласно HSD-тесту Тьюки для множественных сравнений или t-критерию Уэлча–Стьюдента для парных сравнений. Для данных с неравной дисперсией основные эффекты были проанализированы с использованием непараметрического критерия Уилкоксона, при этом каждый парный критерий применяли для множественных сравнений.
Данные FACS анализировали с помощью программного обеспечения FlowJo (США), а статистический анализ выполняли с использованием критерия Колмогорова–Смирнова (непараметрический критерий равенства непрерывных, одноразмерные распределения вероятностей, применяемые для сравнения двух или более образцов — невакцинированных и вакцинированных пулов).
Результаты исследования
Понимание механизма действия иммунизации вакциной MB-1® первоначально требовало установления временнОй динамики сывороточного материнского антитела IgY к IBDV. Характеристику ответа антител против IBDV (материнского и de novo) отслеживали и сравнивали в течение 36 дней как у вакцинированных цыплят (вакцину MB-1® вводили подкожно в суточном возрасте), так и у невакцинированных групп.
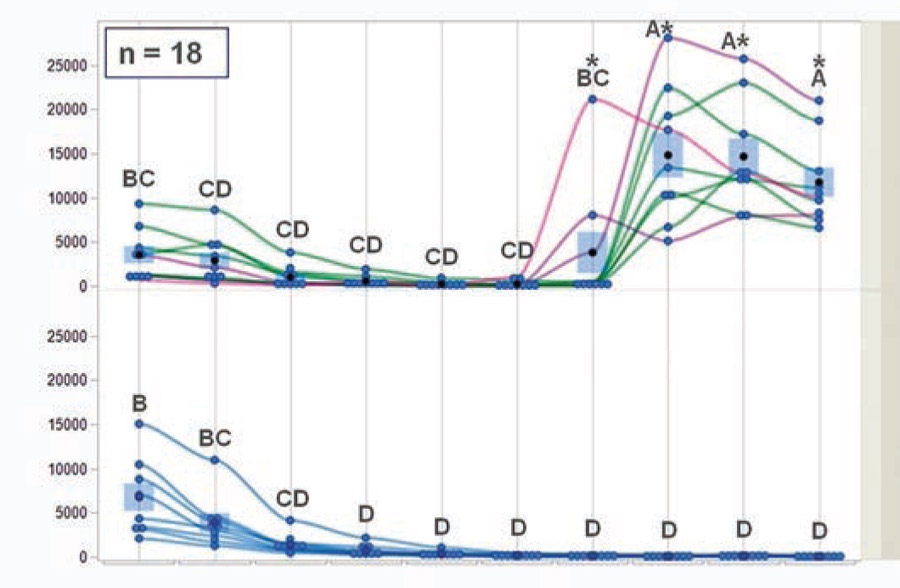
Данные, представленные на рисунке 1, свидетельствуют о высоких и сходных титрах материнских антител IgY к IBDV у вакцинированных (среднее значение — 4766) и невакцинированных (среднее значение — 7743) цыплят в первый день жизни. Далее последовало аналогичное снижение уровня IgY, которое не было зафиксировано на 18‑й день жизни (436 — у вакцинированных цыплят и 217 — у невакцинированных).
Значительное повышение уровня антител происходило в период с 18‑го по 23‑й день жизни только в группе вакцинированных цыплят вследствие выработки у них антител de novo. Затем уровень антител оставался относительно стабильным вплоть до 36‑го дня жизни. Примечательно, что в период сероконверсии наблюдалась высокая степень вариабельности уровня антител у отдельных вакцинированных цыплят. У одних сероконверсия произошла на 18–23-й день жизни (4456), у других — на 23–28-й день жизни (18 486). Оказалось, что большинство цыплят с низкими исходными материнскими антителами (2302) показали раннюю сероконверсию, а особи с высокими исходными антителами (8040) — позднюю сероконверсию (p-значение = 0,0363).
Титры антител определяли с помощью теста ИФА IDEXX IBD-XR Ab. Каждая синяя точка на рисунке 1 обозначает отдельного цыпленка в определенный момент времени. Только в вакцинированной группе цыплят зеленые линии представляют особей с относительно высоким уровнем антител к IBDV, а розовые и фиолетовые линии — особей с относительно низким уровнем антител к IBDV (каждая линия обозначает повторные измерения одного и того же цыпленка). Для каждой временнОй точки и вида лечения синие столбцы представляют собой среднее значение девяти индивидуальных измерений. Для определения достоверности различий между средними значениями в группах использовали двухстороннюю модель ANOVA в дизайне повторных измерений. Группы или дни, обозначенные разными комбинациями букв, достоверно различались (p < 0,05). В период с 23‑го по 36‑й день в связи с неоднородностью дисперсии между группами в течение суток достоверность различий между средними значениями групп определяли с помощью t-критерия Уэлча (p < 0,05). Различия обозначены звездочками (см. рис. 1).
ВременнАя динамика антител IgY к IBDV в сыворотке крови подтверждает нашу гипотезу о выживаемости вакцинного вируса МВ-1® даже в присутствии нейтрализующих МАТ. Это наблюдение позволило предположить, что МАТ препятствовали инфицированию MB-1® своего основного сайта-мишени — бурсы, а способность MB-1® выживать внутри макрофагов обеспечивала выживание вакцинного вируса при эффективной защите МАТ. Как только защита МАТ снижалась, вирусу MB-1® удавалось инфицировать несозревшие В-клетки. Для подтверждения этого принципа действия мы провели количественную оценку и сравнили методом кПЦР концентрацию вируса MB-1® в бурсе, селезенке, тимусе и крови.
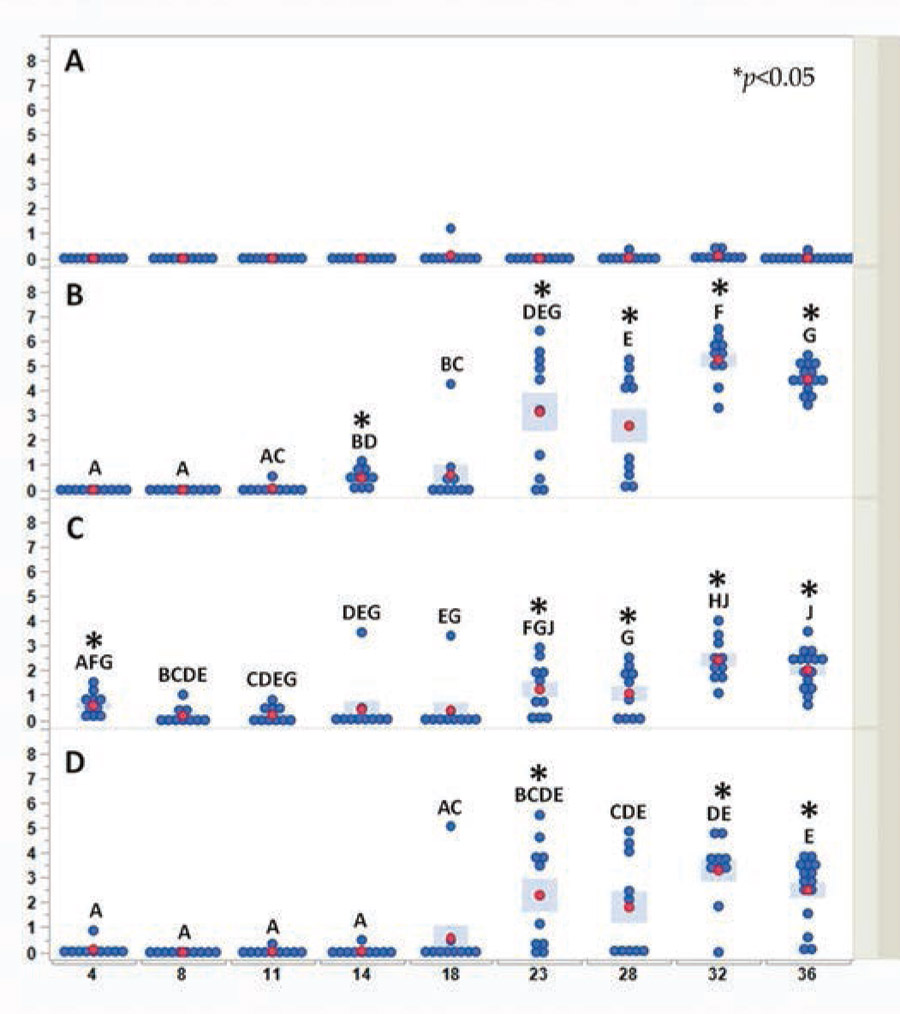
У цыплят контрольной группы во всех исследуемых временнЫх точках зафиксирована нулевая концентрация вируса. У иммунизированных цыплят концентрация вируса в крови (рис. 2, панель А) оказалась низкой или отсутствовала во всех исследуемых временнЫх точках, а значения были близки к пределу детекции. В бурсе (рис. 2, панель В) концентрация вируса MB-1® стала определяться на 14‑й и 18‑й дни жизни. Концентрация вируса значительно превышали предел детекции (особенно высокой концентрация вируса была у одного цыпленка на 18‑й день жизни).
Концентрация вируса росла у все большего количества цыплят, начиная с 18‑го дня жизни, и достигала максимума на 32‑й день жизни (см. рис. 2 панель В). Затем последовало незначительное, но статистически достоверное снижение концентрации вируса на 36‑й день жизни (достоверность различий между временнЫми точками представлена на рисунке 2).
Высокая вариабельность между индивидуумами зарегистрирована в период с 23‑го по 28‑й день жизни. Примечательно, что концентрацию вируса фиксировали в селезенке отдельных цыплят уже на 4‑й день жизни (рис. 2, панель С). Минимальные концетрации вируса оставались стабильными до достижения возраста 18 дней. Особенно высокой была концентрация вируса у одного цыпленка в возрасте 14 дней и у одного цыпленка в возрасте 18 дней. В дальнейшем как умеренное, так и значительное увеличение концентрации вируса выявляли у большинства особей в период с 23‑го по 28‑й день жизни. Показатель достигал максимума в период с 32‑го по 36‑й день, при этом у всех цыплят появлялся иммунный ответ.
Концентрация вируса в селезенке была на несколько порядков ниже, чем в бурсе. Аналогичную картину наблюдали в тимусе (рис. 2, панель D): очень низкие начальные значения концентрации вируса, близкие к пределу обнаружения, зарегистрированы в период с 4‑го по 18‑й день жизни (у одного цыпленка — только на 18‑й день жизни). Начиная с 23‑го дня концентрация вируса у большинства цыплят существенно возрастала и оставалась стабильной до достижения возраста 36 дней. Высокая степень вариабельности отдельных показателей зафиксирована в период с 23‑го по 36‑й день жизни. Как и в селезенке, пиковые уровни концентрации вируса в тимусе были на несколько порядков ниже, чем в бурсе (см. рис. 2, панель D).
У всех цыплят контрольной группы концентрация вируса была равна 0. Концентрацию вируса определяли методом кПЦР и путем пересчета значений Cq с использованием известного стандарта MB-1®. На рисунке 2 каждая синяя точка обозначает отдельного цыпленка в определенный момент времени. Для каждой временнОй точки и органа красные точки и синие столбцы представляют среднее значение десяти отдельных измерений показателей цыплят (на 36‑й день жизни — 15 измерений).
Ввиду неоднородности дисперсии между днями достоверность различий между средними значениями дней определяли с помощью непараметрического критерия Вилкоксона для каждой пары. Дни, обозначенные разными сочетаниями букв, достоверно различаются (p < 0,05). Достоверность различий между группами в пределах среднесуточных значений определяли с помощью t-критерия Уэлча (p < 0,05). Различия отмечены звездочками (см. рис. 2).
В исследовании и написании статьи принимали участие Саар Тал (Saar Tal), Авнер Фингер (Avner Finger, Phibro Animal Health Corporation, Израиль) и Аарон Фридман (Aharon Friedman, Иерусалимский Университет, Израиль).
Статья была опубликована в журнале «Вакцины» в августе 2023 г.
Окончание в следующем номере
Abic Biological
Laboratories Ltd., Израиль
www.pahc.com
www.abiksepta.ru