Контроль микотоксинов в кормах
Мадина АСПАНДИЯРОВА, кандидат технических наук, ведущий специалист
ООО «АТЛ»
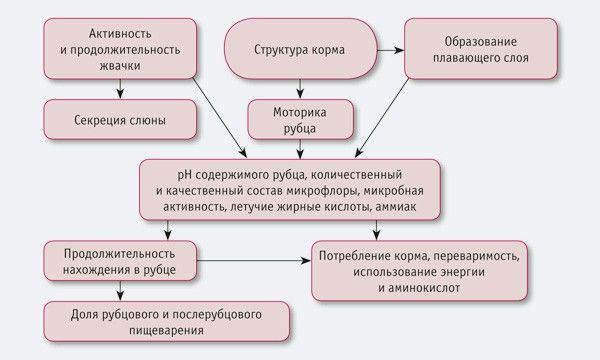
Эффективность современного промышленного животноводства основывается на мировых достижениях селекционно-племенной работы и на научно обоснованных нормах кормления и содержания животных. Принимая во внимание то, что затраты на кормление составляют значительную долю расходов на предприятии, ученые и практики уделяют большое внимание питательности кормов и определяют, как изменяется этот показатель под воздействием биогенных факторов.
Зерновые культуры как основа комбикорма при неблагоприятных условиях выращивания и хранения могут стать токсичными. Некоторые представители сапрофитной микрофлоры в зерне — плесневые, или филаментные, грибы — при определенных параметрах среды производят токсичные низкомолекулярные соединения (вторичные метаболиты). Токсинообразующие грибы, попадающие в пищевую цепочку животных и человека, причисляют к трем родам плесневых грибов: Aspergillus, Fusarium и Penicillium.
Несмотря на достаточно широкий спектр исследований химической природы микотоксинов, ветеринарная токсикология не может досконально объяснить механизм негативного влияния микотоксинов на живой организм.
Неоднократно было доказано, что микотоксины способны встраиваться в различные системы организма и влиять на его функции, оказывая сильное мутагенное, тератогенное и канцерогенное действие. При постоянном поступлении в организм животного вместе с кормами микотоксины накапливаются в тканях и органах. Это может служить причиной необратимых морфологических изменений. Микотоксикозы относят к основным факторам, вызывающим стресс и запускающим механизм перекисного окисления липидов в тканях под воздействием свободных радикалов (Surai P., Mezes M. at all.).
Оксидативный стресс вызывает повреждение важнейших клеточных компонентов, таких как РНК и ДНК, что приводит к нарушению передачи наследственной информации. Это является причиной ухудшения зоотехнических показателей на птицефабриках и свинокомплексах даже при соблюдении рекомендуемых технологий содержания и кормления животных.
По имеющимся данным, в России загрязненность кормов микотоксинами носит устойчивый характер (57,2% с диапазоном изменчивости в разные годы от 34,6 до 79,5%). Чаще всего выявляют Т-2 токсин (38,5%), дезоксиниваленол (13,7%), зеараленон (10,3%), фумонизин (9,9%), а также охратоксин А (16,8%) и афлатоксин В1 (25,5%) (Иванов А., Фисинин В., Тремасов М., Папуниди К., 2010).
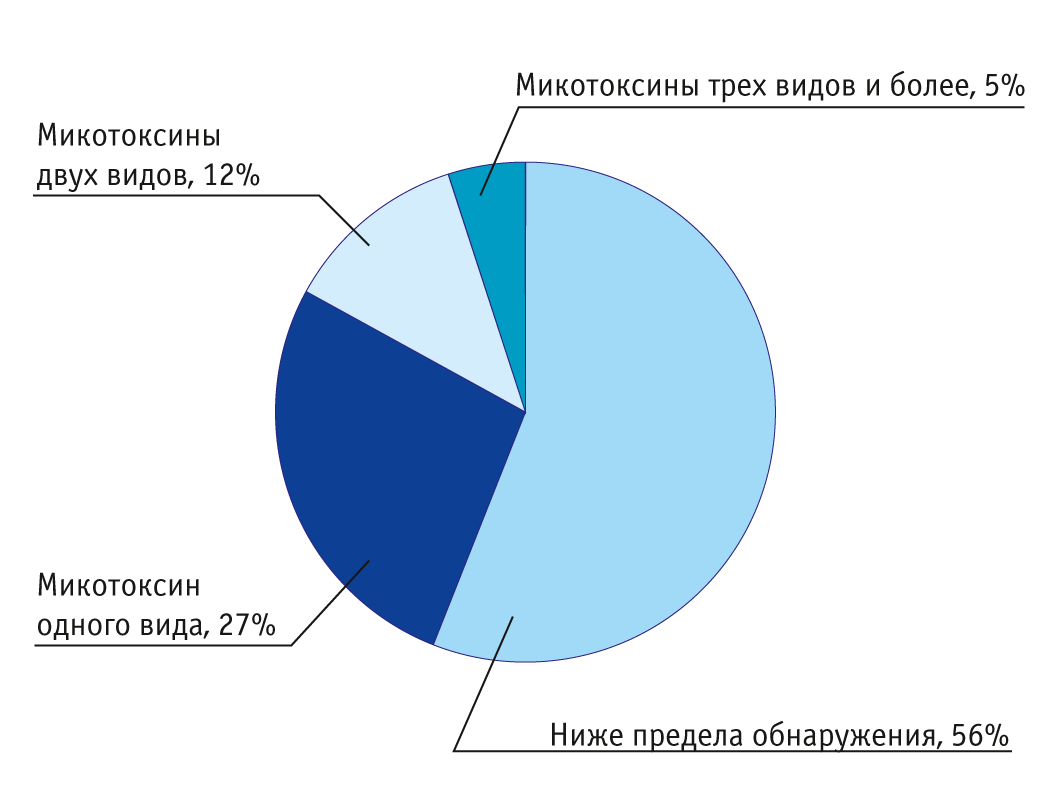
Анализ заготовленных на сельхозпредприятих кормов, проведенный в ФГБНУ «ФЦТРБ-ВНИВИ», показал, что токсичными оказались 25,8% исследованных образцов. В 27% проб были обнаружены микотоксины одного вида, в 12% — двух видов, в 5% — трех и более видов (рисунок).
Корма, содержащие ингредиенты растительного происхождения, подлежат обязательному контролю на загрязнение микотоксинами, что также является неотъемлемым элементом системы сертификации сельскохозяйственной продукции на безопасность.
Правила контроля микотоксинов в кормах для продуктивных животных и допустимые уровни микотоксинов прописаны в «Методических рекомендациях по диагностике, профилактике и лечению микотоксикозов у животных» (Москва, ФГБНУ «Росинформагротех», 2017).
Лабораторный контроль зернового сырья на содержание микотоксинов базируется на разных методах. В их числе — хорошо известные и многократно апробированные ИХА (иммунохроматографический анализ) и ИФА (иммуноферментный анализ). Выбор того или иного метода лабораторной диагностики обусловлен различными факторами: целями мониторинга, техническими и экономическими возможностями лаборатории, официальностью и быстротой предоставляемых результатов, опытом и квалификацией оператора.
Иммуноферментный анализ превосходит другие применяемые методы по чувствительности, показывая высокую избирательность, отсутствие связи с другими химическими веществами и отсутствие ложноотрицательных результатов.
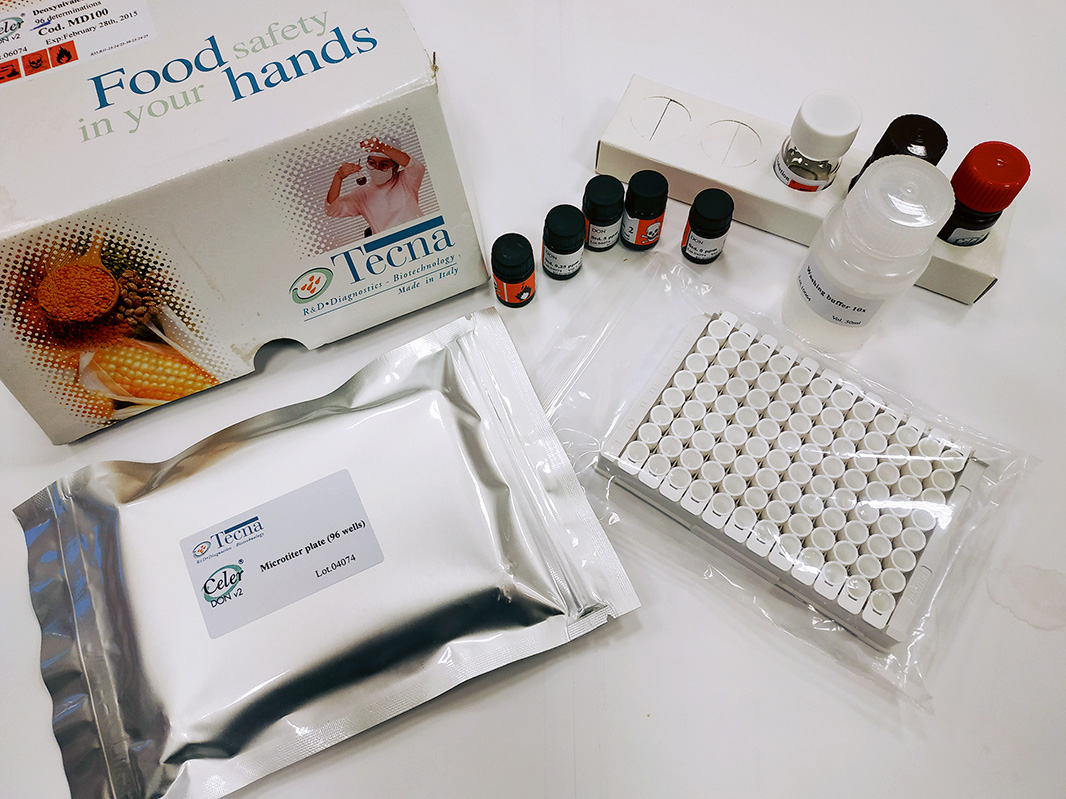
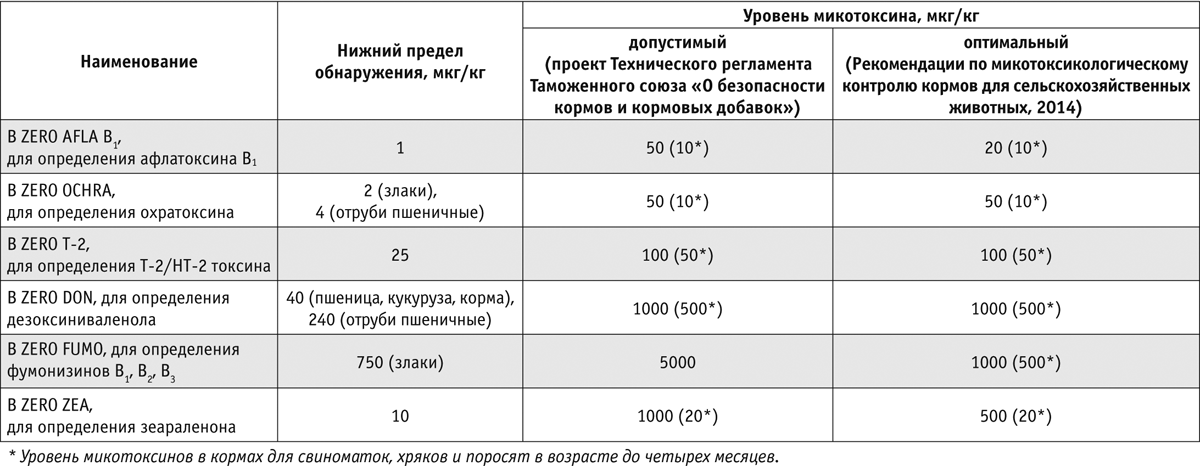
Готовое решение для проведения в производственных лабораториях анализа на содержание микотоксинов — иммуноферментные тест-наборы серии B ZERO (фото) компании Tecna (Италия). В отличие от аналогов данные тест-системы позволяют вести расчет конечного результата, используя одну лунку (вместо пяти-шести) микропланшета при каждой постановке реакции. Таким образом, применяя один тест-набор, можно провести в два раза больше анализов, что подтверждает практическую пользу и быструю окупаемость тест-наборов B ZERO. Немаловажно, что нижняя граница обнаружения микотоксинов в десятки раз ниже нормируемых значений. Сравнительная характеристика чувствительности тест-наборов и регламентируемые уровни содержания микотоксинов в кормах представлены в таблице.
Анализ проводят в специальных полистироловых планшетах, на поверхности которых проходит реакция конкурентного связывания реагента с антителами свободных молекул микотоксинов в исследуемом образце и молекул, конъюгированных ферментом. В результате реакции на поверхности твердой фазы формируются прочные иммунные комплексы, а несвязанные компоненты удаляются путем отмывки планшета.
Активный центр фермента в образовавшихся иммунных комплексах остается доступным для взаимодействия с субстратом. Последующая инкубация субстрата с иммобилизованным конъюгатом приводит к окрашиванию образца в синий цвет. Реакция окрашивания останавливается при добавлении стоп-реагента, при этом синий цвет меняется на желтый. Интенсивность окраски выражают величиной оптической плотности продуктов реакции. Измерение оптической плотности производят микропланшетным ридером при длине волны света 450 нм. Содержание микотоксина определяют по графику зависимости между оптической плотностью реакционной смеси, измеренной в микролунках со стандартными образцами микотоксинов, и концентрацией микотоксинов в пробе.
ООО «АТЛ»
Тел./факс: +7 (495) 981‑60‑69
Моб. тел.: +7 (967) 144‑26‑52
E-mail: atlmos.ru@gmail.com
www.atl-ltd.ru