Препарат Актигентм в рационах для поросят-отъемышей
Общеизвестно, что послеотъемный период — самый критический в жизни поросенка, ведь при резкой смене рационов, социальной среды и условий содержания на организм животного воздействует много различных стресс-факторов (Lalles et al., 2007; Gresse et al., 2017). Вследствие этого у поросят может начаться диарея и приросты живой массы значительно уменьшатся (Heo et al., 2013). Поддержание здоровья кишечника — первостепенная задача при выращивании поросят-отъемышей.
Антибиотики и маннанобогащенная фракция
Антибиотики — стимуляторы роста давно используют в свиноводстве для профилактики диареи после отъема (Verstegen, Williams, 2002). Однако применение таких препаратов нередко вызывает побочные эффекты, например, нарушение баланса между разными представителями естественной микрофлоры кишечника. А это — основная причина возникновения диареи у поросят (Tsukahara, Ushida, 2002; Tsukahara et al., 2003).
Не менее важная проблема, которую сегодня приходится решать ученым, правительству разных стран и производителям мяса, — устойчивость микроорганизмов к антибиотикам и передача факторов резистентности от патогенов, присутствующих в организме животного, патогенам, потенциально опасным для человека (Allen et al., 2013).
Для прикрепления к клеткам кишечника (энтероцитам) и последующей его колонизации некоторые патогенные микроорганизмы (Salmonella, Escherichia coli) используют особые рецепторы, расположенные на поверхности своих фимбрий (микроворсинки, нитевидные белковые структуры). В фимбриях первого типа присутствуют белки лектины, высокоспецифично связывающие маннозные остатки на поверхности энтероцитов. Фактически маннозные остатки служат своеобразным якорем для патогенных микроорганизмов, так как позволяют им закрепляться на поверхности клеток кишечника и колонизировать его.
Альтернативой антибиотикам могут стать препараты на основе маннанобогащенной фракции (ее выделяют из клеточной стенки дрожжей Saccharomyces cerevisiae). Будучи аналогом поверхностных маннозных остатков энтероцитов, маннанолигосахариды блокируют рецепторы болезнетворных микроорганизмов, тем самым лишая их способности прикрепляться к стенке кишечника. В результате предотвращается его колонизация бактериями и сдерживается размножение патогенов (Brennan et al., 2014; Spring et al., 2015).
Актигентм производства компании Alltech Inc. (США) — препарат на основе маннанобогащенной фракции. Результаты многочисленных исследований, проведенных на птицефабриках и свинокомплексах, показали, что при использовании препарата Актигентм существенно улучшилось здоровье желудочно-кишечного тракта и состояние иммунной системы бройлеров, свиноматок и свиней на откорме и значительно повысилась продуктивность животных (Brennan et al., 2014; Edwards et al., 2014; Spring et al., 2015; Taylor-Pickard et al., 2017).
Мы провели исследования, чтобы определить, как влияет применение препарата Актигентм на рост, барьерные функции кишечника и здоровье поросят-отъемышей. Кроме того, путем сравнения показателей, полученных при использовании антибиотиков и препарата Актигентм, оценили эффективность применяемых антибактериальных средств.
В эксперименте задействовали 150 здоровых поросят генотипа дюрок × ландрас × йоркшир в возрасте 30 дней (отъем производили в 21 день).
Методом случайной выборки животных разделили на три группы — контрольную и две опытные — по 50 голов в каждой (5 повторностей по 10 поросят в группе). В каждой группе было одинаковое количество самцов и самок.
Поросята контрольной группы получали отвечающий требованиям NRC (National Research Council, 2012) стандартный рацион без антибиотиков. В кормосмесь для животных первой опытной группы включали антибиотики — колистина сульфат (100 мг/кг), олаквиндокс (100 мг/кг) и китасамицин (50 мг/кг), для сверстников второй опытной группы — препарат Актигентм (800 мг/кг). Эксперимент длился 28 суток.
Дважды в день, в 8:00 и 18:00, выявляли поросят с признаками диареи. Всех подопытных для расчета приростов живой массы взвешивали в начале и по окончании опыта. Уровень потребления корма в каждом станке рассчитывали исходя из показателей приростов живой массы поросят.
На 28‑й день в контрольной и опытных группах отобрали по пять самок и по пять самцов без признаков диареи. Из яремной вены животных взяли по 10 мл крови для анализа. Пробы крови инкубировали при комнатной температуре в течение 1 часа, после чего пробирки с образцами центрифугировали при 1000 g в течение 15 минут. Полученную сыворотку хранили при температуре 20 °С.
Сразу после отбора проб крови произвели убой поросят и согласно методике, описанной Yang и соавт. в 2014 г., для исследования взяли тонкий кишечник. Фактически выделяли три его сегмента: ближайший к привратнику желудка участок двенадцатиперстной кишки, средний участок тощей кишки и прилежащий к илеоцекальному соединению дистальный участок подвздошной кишки.
Для определения морфологического состава кишечника сегменты двенадцатиперстной, тощей и подвздошной кишки иссекли, полученные образцы промыли 0,9%-м физиологическим раствором и зафиксировали в 4%-м формальдегиде. Слизистую оболочку аккуратно соскребали с внутренней поверхности двенадцатиперстной, тощей и подвздошной кишки предметным стеклом. Полученные образцы сразу же замораживали в жидком азоте и хранили при температуре –80 °С. После этого проводили экстракцию РНК и белков.
Гистологические препараты сегментов кишечника получали по методике Wang и соавт. (2017), окрашивали реактивом Шиффа (фуксинсернистая кислота) по методике McClemens и соавт. (2013) для выявления в двенадцатиперстной, тощей и подвздошной кишке PAS-положительных (PAS-реакция — гистохимический метод выявления гликогена, нейтральных глико- и мукопротеидов, сиаломукопротеидов и гликолипидов) бокаловидных клеток. Рассчитывали соотношение между бокаловидными клетками и ворсинками.
Концентрацию воспалительных цитокинов (IL-1β, IL-4 и IL-10) и D-молочной кислоты (DLA) в сыворотке крови определяли при помощи ИФА-наборов (Nanjing Jiancheng Bioengineering Institute, Nanjing, China), содержание TNF-α (фактор некроза опухолей) — методом радиоиммунного анализа (Tianjin Jiuding Bioengineering Co Ltd, Tianjing, China), экспрессию (синтез на клеточном уровне) белков плотных контактов и белков, ассоциированных с толл-подобным рецептором 4 (TLR-4), — методом Вестерн-блоттинг (Meng et al., 2017).
Зоотехнические показатели
Исследования показали, что ввод антибиотиков или препарата Актигентм в рационы для поросят не повлиял на среднесуточные приросты живой массы, потребление корма и его конверсию. Тем не менее отмечено, что в группе, где в кормосмесь добавляли Актигентм, случаев проявления диареи зарегистрировали меньше, чем в контрольной группе (3,3% против 6,54%).
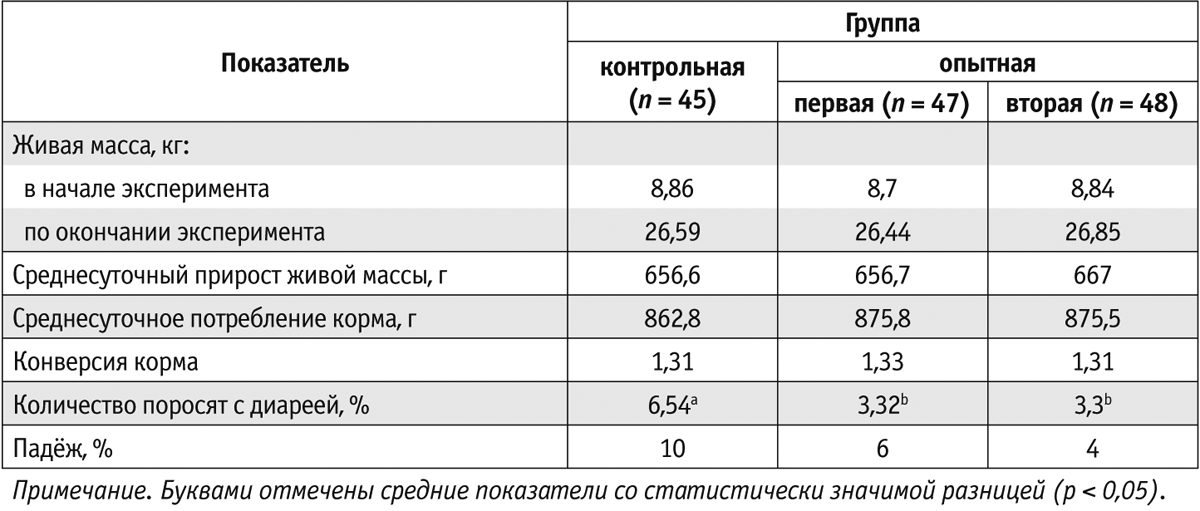
В научной литературе есть информация о том, что Актигентм целесообразно применять для профилактики диареи у поросят после отъема (Torrecillas et al., 2015). В первой и во второй опытных группах поросят с диареей оказалось соответственно 3 и 3,32%. Это подтверждает высокую эффективность препарата Актигентм. К тому же в группе, где животные получали Актигентм, уровень падежа был минимальным (табл. 1).
Морфология кишечника
Применение антибиотиков привело к уменьшению высоты ворсинок и снижению соотношения высоты ворсинок к глубине крипт на всех участках двенадцатиперстной, тощей и подвздошной кишки (р < 0,01). В подвздошной кишке поросят, получавших препарат Актигентм (вторая опытная группа), высота ворсинок оказалась больше, чем в подвздошной кишке сверстников контрольной группы.
В двенадцатиперстной, тощей и подвздошной кишке животных второй опытной группы высота ворсинок была больше, чем в двенадцатиперстной, тощей и подвздошной кишке аналогов, потреблявших кормосмесь с антибиотиками (р < 0,05). Такую же закономерность установили при расчете соотношения между высотой ворсинок и глубиной крипт двенадцатиперстной, тощей и подвздошной кишки животных контрольной и опытных групп (р < 0,01). Данные морфологических исследований участков тонкого кишечника подсвинков представлены на рисунке 1.
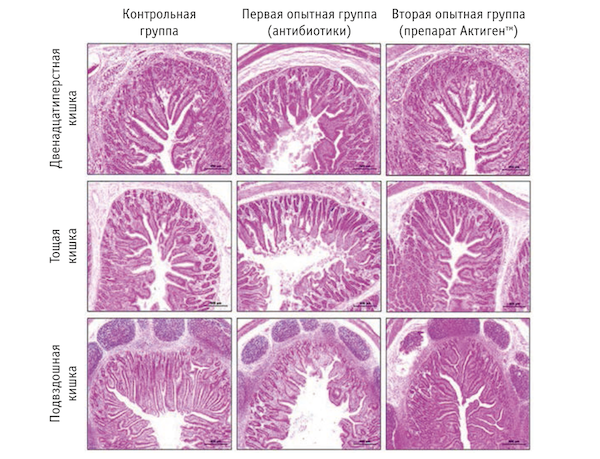
На рисунке 1 видно, что при использовании препарата Актигентм состояние тонкого кишечника улучшилось. Благодаря этому увеличилась его абсорбционная площадь (Ruttanavut, Yamauchi, 2010). О положительном влиянии препарата Актигентм на морфологию кишечника ранее сообщали Sims и соавт. (2004) и Zhao и соавт. (2012).
В двенадцатиперстной кишке поросят, получавших антибиотики, бокаловидных клеток было меньше, чем в двенадцатиперстной кишке сверстников, потреблявших стандартный рацион (р < 0,05). Применение препарата Актигентм, наоборот, способствовало увеличению количества бокаловидных клеток и повышению выработки муцина (выделяемые бокаловидными клетками гликопротеины, играющие важную роль в обеспечении барьерной функции кишечника) в двенадцатиперстной и тощей кишке (р < 0,05). Данные исследований представлены в таблице 2.
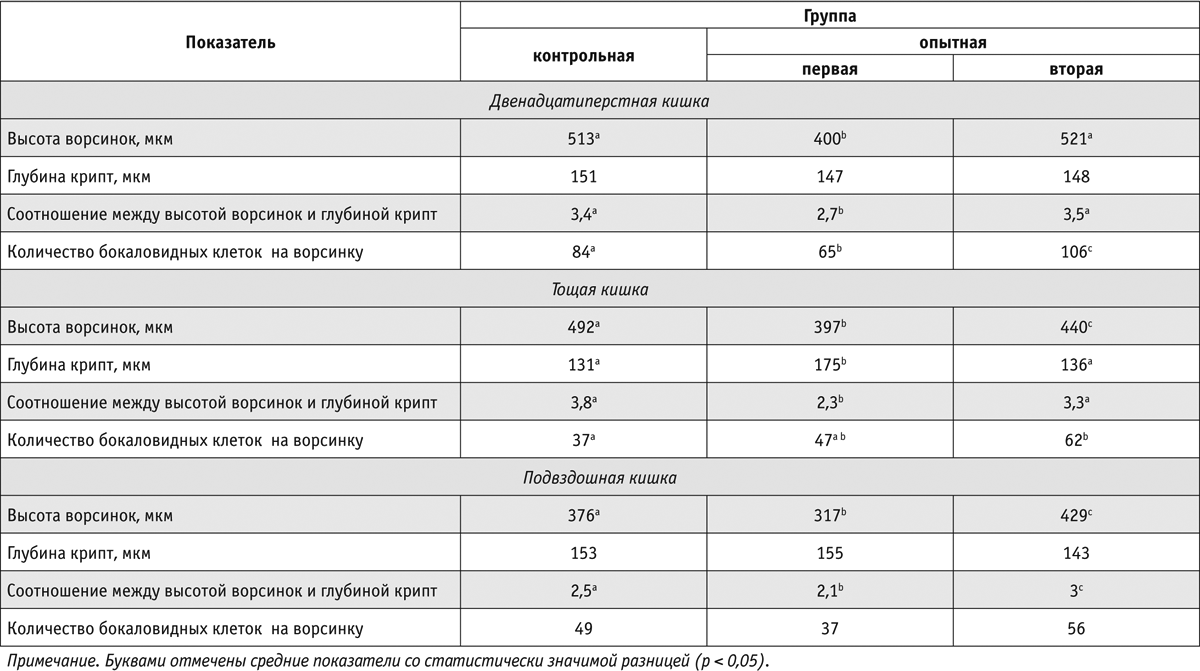
Полученные результаты свидетельствуют о том, что при использовании препарата Актигентм улучшилась неспецифическая защита кишечника от патогенной микрофлоры. Данные наших исследований согласуются с данными, полученными в 2014 г. Pourabedin и соавт. в экспериментах на бройлерах.
Экспрессия белков плотных контактов
Белки плотных контактов — межклеточные белки, выполняющие структурную роль и обеспечивающие связь между соседними клетками (рис. 2). Плотные контакты препятствуют перемещению крупных молекул и воды сквозь межклеточное пространство в просвет кишечника и защищают внутреннюю среду организма от внедрения патогенных микроорганизмов.
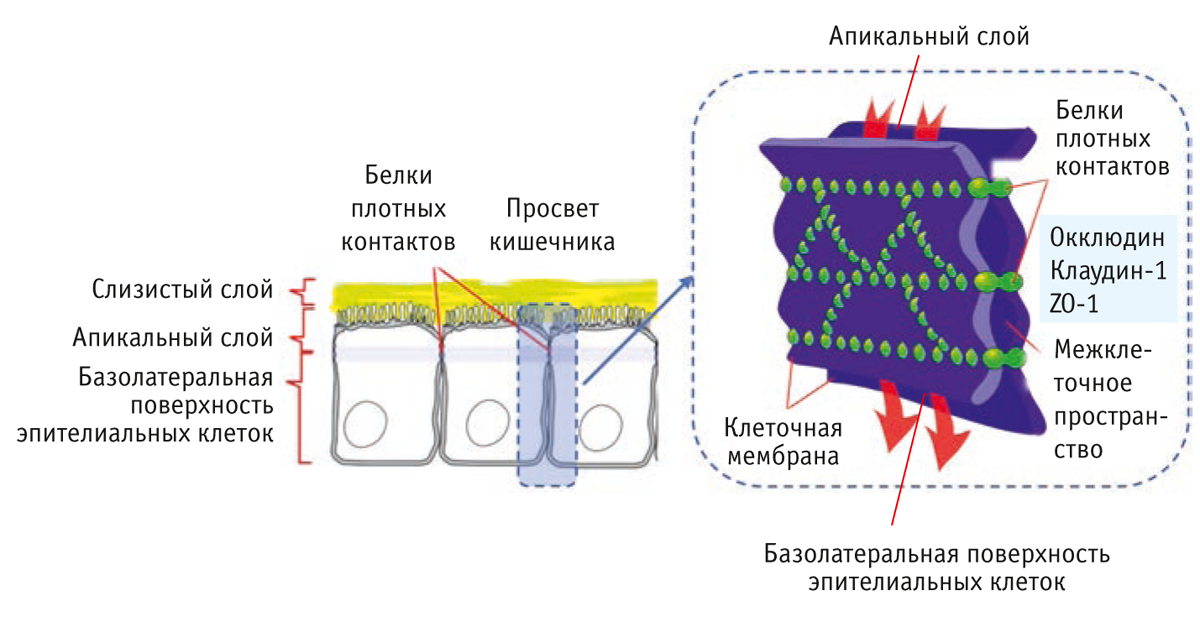
Мы определили экспрессию трех типов белков плотных контактов — ZO-1, окклюдина и клаудина-1 (рис. 3). Отмечено, что в слизистой оболочке двенадцатиперстной и подвздошной кишки поросят, получавших антибиотики, синтезировалось меньше белков плотных контактов, чем в слизистой оболочке двенадцатиперстной и подвздошной кишки животных контрольной группы. В то же время в слизистой оболочке двенадцатиперстной и тощей кишки поросят, получавших препарат Актигентм, увеличилась экспрессия ZO-1 и окклюдина (р < 0,01), а в слизистой оболочке подвздошной кишки — окклюдина (р < 0,05).
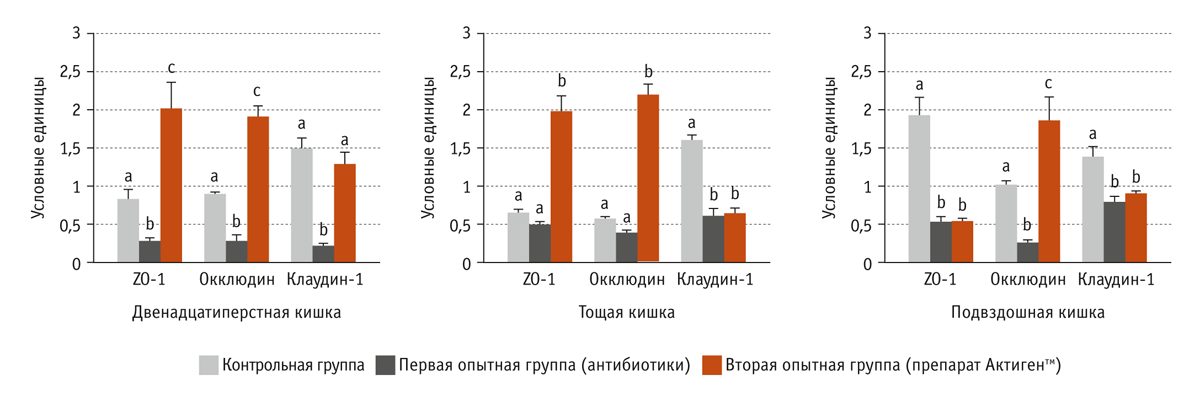
Результаты эксперимента свидетельствуют о том, что при вводе в рационы препарата Актигентм в тонком кишечнике поросят-отъемышей увеличилась экспрессия белков плотных контактов.
Белки плотных контактов оказывают влияние на проницаемость стенок кишечника (Shen et al., 2011). В научной литературе есть много данных о том, что при использовании антибиотиков проницаемость стенок кишечника повышается. Из-за этого его барьерная функция ухудшается (Tulstrup et al., 2015; Yoon et al., 2018). Результаты наших исследований показали: при вводе в кормосмесь антибиотиков снижалась частота возникновения диареи у поросят, однако при этом повышалась проницаемость стенок кишечника. Это обусловлено уменьшением экспрессии белков плотных контактов.
Применение препарата Актигентм способствовало увеличению экспрессии белков плотных контактов, благодаря чему проницаемость стенок кишечника снижалась. О положительном влиянии препарата Актигентм на экспрессию белков плотных контактов в энтероцитах свиней сообщают также K. Horgan и соавт. (2018).
Проницаемость стенок кишечника
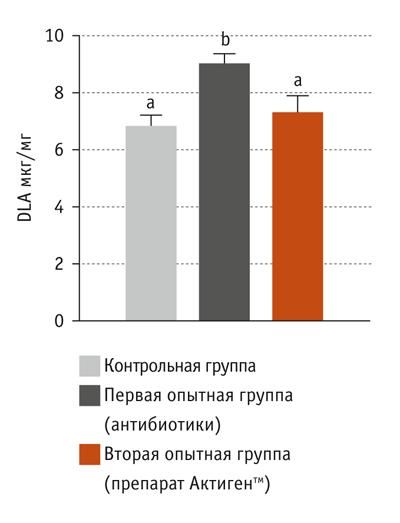
Еще одним общепринятым индикатором проницаемости стенок кишечника служит концентрация DLA (D-молочной кислоты) в сыворотке крови (Rong et al., 2015; Yu et al., 2017). Повышение уровня DLA в сыворотке крови говорит о том, что проницаемость стенок кишечника увеличилась.
Результаты эксперимента показали, что в сыворотке крови поросят, потреблявших корм с антибиотиками, содержание DLA в сыворотке крови было выше, чем в сыворотке крови аналогов, получавших стандартный рацион и кормосмесь с препаратом Актигентм (р < 0,05). Это говорит о том, что барьерная функция кишечника животных первой опытной группы существенно ухудшилась (рис. 4). Таким образом было доказано, что при использовании антибиотиков снижается экспрессия белков плотных контактов и уменьшается выработка муцина. Вследствие этого проницаемость стенок кишечника свиней повышается.
В сыворотке крови поросят, получавших препарат Актигентм, концентрация DLA была достоверно ниже, чем в сыворотке крови аналогов, потреблявших корм с антибиотиками. Следовательно, применение препарата Актигентм положительно влияет на экспрессию белков плотных контактов и синтез муцина в бокаловидных клетках кишечника.
Уровень воспалительных цитокинов в сыворотке крови
Цитокины — обобщенное название обширной группы небольших белковых молекул (их атомная масса варьирует от 5 до 20 кДа). Цитокины участвуют в иммунных процессах, протекающих в организме, и обеспечивают передачу сигналов между клетками.
Установлено, что при вводе в кормосмесь антибиотиков в сыворотке крови поросят повысился уровень провоспалительных цитокинов IL-1β (р < 0,05). Использование же препарата Актигентм активизировало противовоспалительный ответ: в сыворотке крови животных уменьшилась концентрация провоспалительных цитокинов TNF-α, а концентрация противовоспалительных цитокинов IL-10 увеличилась (рис. 5).
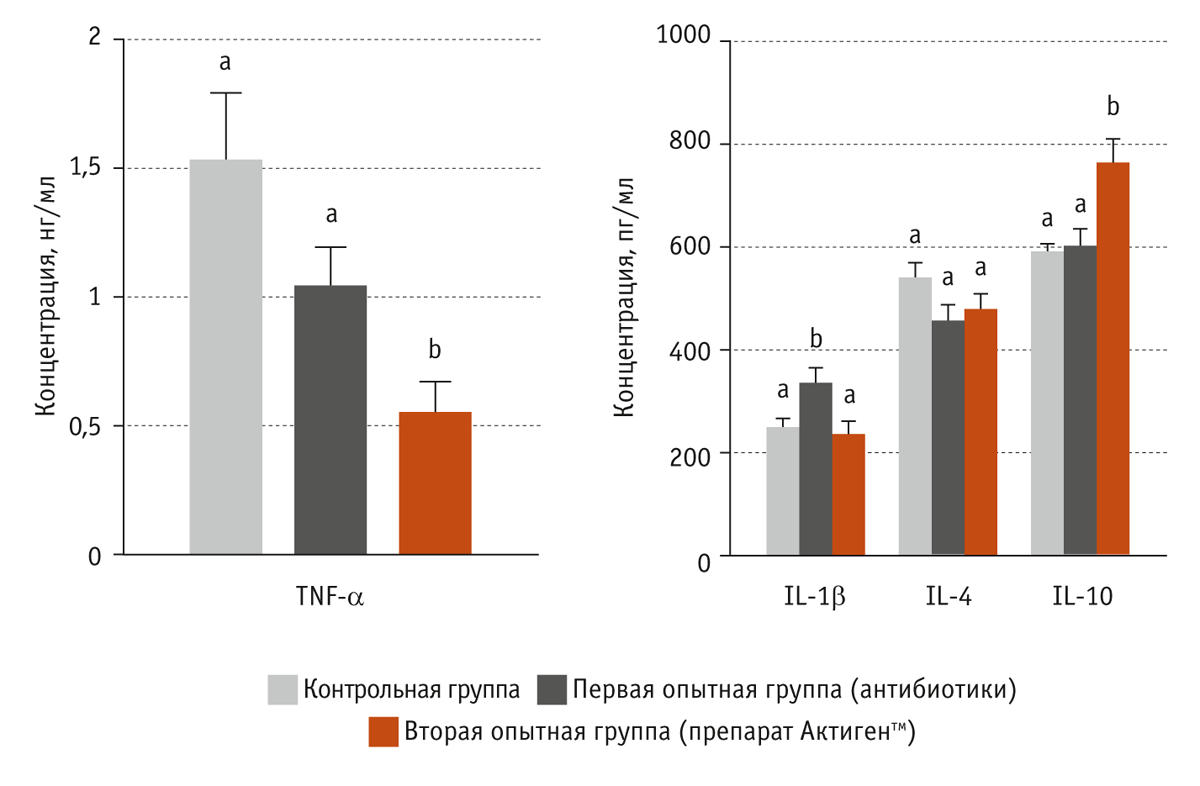
Провоспалительные цитокины IL-1β и TNF-α клетки продуцируют в ответ на внедрение патогенов и при повреждении тканей. Эти провоспалительные цитокины стимулируют развитие местной воспалительной реакции. Противовоспалительный цитокин IL-10, наоборот, ингибирует секрецию провоспалительных цитокинов TNF-α и IL-1β.
Результаты проведенных ранее исследований также свидетельствуют о том, что ввод маннанолигосахаридов в рационы для сельскохозяйственных животных положительно влияет на барьерные функции кишечника и способствует уменьшению воспаления (Zanello et al., 2011; Che et al., 2012; Jawhara et al., 2012).
Экспрессия белков сигнального пути TLR-4 в слизистой оболочке подвздошной кишки TLR-4 относится к классу мембранных белков (особые клеточные рецепторы), которые распознают липополисахариды микроорганизмов и активизируют клеточный иммунный ответ. Передающийся через TLR-4 сигнал — один из древнейших сигналов в системе антибактериальной защиты организма (Verstrepen et al., 2008).
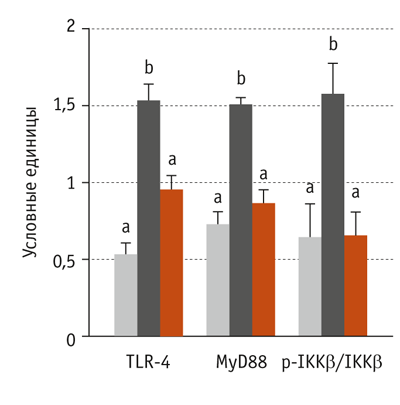
Использование антибиотиков привело к повышению экспрессии TLR-4 и MyD88 (цитозольный адаптерный белок, участвующий в передаче сигнала от толл-подобных рецепторов) и увеличению соотношения между p-IKKβ и IKKβ, что свидетельствует об активации сигнального пути TLR-4. При сравнении данных, полученных в контрольной и во второй опытной группах, установили, что применение препарата Актигентм не оказало влияния на экспрессию белков сигнального пути TLR-4 (рис. 6).
TLR-опосредованная передача сигналов вовлечена в иммунный ответ (Lucas, Maes, 2013; Li et al., 2015; Achek et al., 2016). В энтероцитах поросят, получавших антибиотики, повысилась экспрессия белков, связанных с TLR-4, что свидетельствует об активации этого сигнального пути. В энтероцитах животных, потреблявших кормосмесь с препаратом Актигентм, экспрессия белков TLR-4 была достоверно ниже, чем в энтероцитах аналогов, потреблявших кормосмесь с антибиотиками. Таким образом доказано, что препарат Актигентм оказывает модулирующее влияние на воспалительный ответ. Аналогичных результатов достигли исследователи Badia и соавт. (2012). Они установили, что компоненты дрожжевых клеток могут подавлять экспрессию TLR-4 в энтероцитах свиней (Badia et al., 2012).
В научной литературе есть информация о том, что развитие воспалительных процессов в подвздошной кишке может затормаживаться благодаря улучшению морфологии кишечника и увеличению экспрессии белков плотных контактов в энтероцитах (Liu et al., 2008). При вводе в рационы препарата Актигентм улучшилась барьерная функция кишечника поросят-отъемышей.
Таким образом, научно доказано и подтверждено данным исследованием, что при вводе препарата Актигентм в рационы для поросят-отъемышей улучшаются морфология и барьерные функции кишечника, а также снижается неспецифический воспалительный ответ. При этом показатели интенсивности роста, сохранности поросят, частоты возникновения у них диареи, а также конверсия корма оказались такими же, как и при использовании антибиотиков.
Статья опубликована в журнале Livestock Science в 2019 г. (Song Min, Fan Yijie, Su Han, Ye Jiayi, Liu Fangfang, Zhu Xiaotong, Wang Lina, Gao Ping, Shu Gang, Wang Zhonggang, Zhu Fang, Lin Gang, Xue Yan, Jiang Qingyan, Wang Songbo).
ООО «Оллтек»
105062, Москва, Подсосенский пер., д. 26, стр. 3
Тел.: +7 (495) 258‑25‑25
E-mail: russia@alltech.com
www.alltech.com/russia