Статья предоставлена ООО «Зоэтис»
Возбудитель инфекционного бронхита кур (ИБК) — коронавирус. Он поражает птицу всех возрастов, но у молодых особей заболевание имеет более выраженные признаки и чаще приводит к падежу, особенно при вторичном инфицировании бактериальными патогенами. Вирус ИБК в основном вызывает респираторные заболевания и нефрит у цыплят, но иногда приводит и к уменьшению прироста массы тела, снижению яйценоскости, увеличению количества яиц с аномалиями и повышению смертности птицы (Кавана, Гелб, 2008).
Вирус ИБК может подвергаться генетической мутации и рекомбинации, что приводит к сдвигам и дрейфу антигенов и вызывает необходимость в постоянном изменении программ вакцинации (Коок и др., 2012). Такие серотипы вируса, как D207 (D274), D212 (D1466) (Давелаар и др., 1984), 793B (4/91) (Гоф и др., 1992), D388, или QX (Ворфингтон и др., 2008), и израильские варианты 1 и 2 (Каллисон и др., 2001) — результат эволюции вируса в последние десятилетия. Таким образом, в мире идентифицировано несколько серотипов вируса, к которым у птицы не формируется перекрестный иммунитет (Джеквуд и др., 2012).
Серотип 793B детально изучен и описан. В Европе его обнаруживают в 30% проб, поступающих с товарных предприятий (Ворфингтон и др., 2008). Вирус в основном вызывает респираторные заболевания, но иногда может приводить к развитию необычной патологии, в частности двусторонней миопатии, и падежу взрослой птицы (Гоф и др., 1992).
В последние годы разработаны новые вакцины на основе полевых штаммов, например 4/91 (Коок и др., 2001) и QX-подобного штамма L1148 (Герлигс и др., 2011). Однако своевременно создавать вакцины против каждого возникающего штамма очень сложно. Альтернативой может стать применение комбинаций вакцин. Ученые оценили эффективность формирования перекрестного иммунитета к штаммам ИБК различных серотипов. Были описаны результаты исследований по выработке перекрестного иммунитета (Ванг и др., 1996; Кавана и др., 1997; Лим и др., 2012), в ходе которых удалось обеспечить защиту поголовья, но ее степень варьировала от очень слабой до умеренной.
Известно, что вирусы израильского варианта 2, такие как изолят IS/1494/06, — нефропатогенные (Сусан и др., 2010). Они также могут поражать дыхательную систему. Несмотря на использование в некоторых странах Ближнего Востока вакцины на основе штамма H120, до сих пор не решены проблемы, связанные с циркуляцией штамма IS/1494/06 (Селим и др., 2013). Он обнаружен в Ливии (Авад и др., 2014) и в Турции (Кахиа и др., 2013). Хотя предпочтительно применение вакцин, обеспечивающих гомологическую защиту от циркулирующих диких штаммов, в полевых условиях на птицу могут одновременно воздействовать несколько различных вариантных штаммов ИБК. Поэтому важно знать, обеспечат ли определенные комбинации вакцин достаточный уровень перекрестной защиты как от гомологичных, так и от гетерологичных штаммов.
Сегодня на рынке стран Евросоюза представлены вакцины на основе QX-подобного штамма ИБК. QX — это один из новых вариантов вируса, впервые выделенный в Китае (Ванг и др., 1998). С тех пор QX-подобные вирусы распространились по всему миру, в том числе в европейских государствах: Бельгии, Великобритании, Германии, Италии, Нидерландах и Франции (Монне и др., 2008; Ворфингтон и др., 2008). QX-подобные варианты ИБК вызывают появление в стаде «ложных» несушек, заболевания дыхательной системы и почек у птицы, что приводит к повышению ее смертности и снижению продуктивности (Ворфингтон и др., 2008; де Вит и др., 2011).
Мы провели четыре исследования, чтобы установить, обеспечивает ли вакцина на основе QX-подобного штамма (Герлигс и др., 2011) при ее применении в комбинации с вакцинами, содержащими вирус серотипа Массачусетс (штаммы H120 и IBММ 1263, а также голландский штамм D274), защиту от вируса серотипа 793B и израильского варианта 2 (IS/1494/06).
Для первого, второго и четвертого исследований были отобраны цыплята, выведенные из яиц, свободных от специфических патогенов (СПФ), компаний Valo BioMedia и Lohmann Tierzucht, для третьего исследования использовали СПФ-цыплят компании Animal Health Service GD.
Поголовье разделили на группы и разместили в изоляторах. В ходе исследований ежедневно контролировали температуру воздуха. В начале опыта она составляла 30 °C, а затем постепенно снижалась до 24–20 °C. Цыплят кормили вволю комплексным коммерческим кормом в соответствии с их возрастом, доступ к водопроводной воде был постоянным.
Условия содержания птицы и проведения экспериментов отвечали требованиям Правил охраны здоровья и благополучия животных. Процедуры были утверждены местными комитетами по защите животных перед началом исследования.
В опытах использовали различные коммерческие вакцины: Poulvac® IBMM, содержащую штамм IBMM 1263, Poulvac® IB Primer на основе штаммов H120 и D274 и Poulvac® IB QX, в состав которой входит аттенуированный QX-подобный штамм. При применении всех этих вакцин использовали указанный при производстве титр вируса, чтобы рассчитать необходимую степень разведения в фосфатно-солевом буферном растворе (ФСБР) и получить минимальный титр штамма на 1 дозу в количестве 103 ЭИД50 (50%-я эмбриональная инфицирующая доза). Когда две вакцины вводили одновременно, объем ФСБР, используемый при разведении, рассчитывали таким образом, чтобы минимальный титр штамма в обеих вакцинах был одинаковым.
Для контрольного заражения применяли штаммы 793B Ливерпульского университета (Аджар и др., 1997) и израильского варианта 2 (IS/1494/06), выделенного во время вспышки ИБК в Египте (Сусан и др., 2010). Вакцины и вирусы для контрольного заражения хранили в ледяной ванночке до начала использования. Время между растворением и вводом птице как вакцин, так и контрольных штаммов не превышало двух часов. План исследований (таблица) был основан на требованиях Европейской фармакопеи к эффективности живых вакцин против инфекционного бронхита (04/2013:0442).
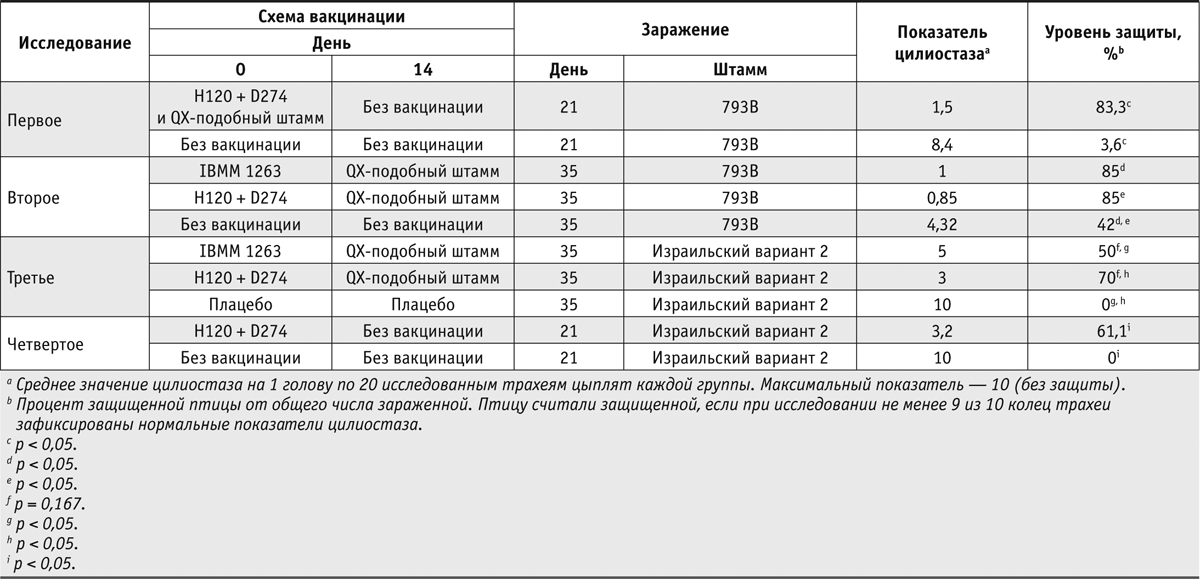
Первое исследование провели на группе цыплят, которым в первые сутки жизни ввели комбинированную вакцину, содержащую штаммы H120 и D274, и вакцину на основе QX-подобного штамма.
Во втором исследовании подопытных цыплят разделили на две группы: одну иммунизировали вакциной, содержащей штамм IBMM 1263, а вторую — комбинированной вакциной на основе штаммов H120 и D274 в первые сутки жизни. Птицу обеих групп в возрасте 14 суток ревакцинировали вакциной, в состав которой входил QX-подобный штамм.
Третье исследование провели на двух группах цыплят. В первые сутки жизни поголовье первой группы вакцинировали препаратом, содержащим штамм IBMM 1263, второй — вакциной на основе штаммов H120 и D274. В обеих группах в 14 дней птицу ревакцинировали вакциной, в состав которой входил QX-подобный штамм.
В четвертом исследовании цыплят вакцинировали в первые сутки жизни вакциной, содержащей штаммы H120 и D274.
Для проведения всех четырех исследований формировали контрольную группу невакцинированной птицы. В каждой контрольной и опытной группе было по 20 цыплят, имеющих уникальный номер на крыле для индивидуальной идентификации.
Через три недели после последней вакцинации произвели контрольное заражение птицы: при первом и четвертом исследованиях — в возрасте 21 дня, при втором и третьем (когда цыплят ревакцинировали в 14 дней) — в возрасте 35 дней. В ходе первого и второго исследований птицу заразили штаммом 793B, третьего и четвертого — штаммом израильского варианта 2.
После контрольного заражения в первом исследовании птицу случайным образом распределили по трем изоляторам, во втором — оставили в прежних изоляторах, в третьем — соединили таким образом, чтобы все цыплята могли свободно передвигаться, в четвертом — каждую группу случайным образом разделили на две подгруппы и разместили в отдельных изоляторах. В течение пяти дней после заражения за цыплятами вели наблюдение для выявления клинических признаков заболевания, после чего птицу усыпляли путем внутривенного введения 20%-го раствора пентобарбитала натрия. У каждого цыпленка брали образцы трахеи и делали поперечные срезы: три — верхней части, четыре — средней и три — нижней. Непосредственно перед вакцинацией, перед заражением и через пять дней после него (за исключением третьего исследования) у птицы брали образцы крови и определяли титры антител к ИБК.
Лиофилизированные вакцины были разведены в дистиллированной воде в соответствии с инструкциями производителя. При заражении цыплят штаммом 793B (первое и второе исследование), а также штаммом израильского варианта 2 (четвертое исследование) вакцины применяли в виде крупнокапельного спрея с помощью распылителя. В третьем исследовании (при заражении цыплят штаммом израильского варианта 2) вакцинацию проводили путем введения препарата в виде капель в глаза и ноздри. В общей сложности на каждую голову приходилось 0,1 мл разведенной вакцины (по 0,05 мл в глаз и ноздрю).
Штаммы для контрольного заражения перед началом исследования титровали на куриных эмбрионах для расчета ЭИД50. Штамм 793B вводили в дозе 105 ЭИД50, а штамм израильского варианта 2 — в дозе 104 ЭИД50. Вирусы для контрольного заражения разбавляли дистиллированной водой и хранили охлажденными. Вводили птице в виде капель в глаза и ноздри в объеме 0,1 мл на дозу.
Активность мерцательного эпителия трахеальных эксплантатов оценивали через пять дней после контрольного заражения. Эксплантаты трахеи помещали в фосфатно-солевой буферный раствор при температуре 37 °C и исследовали микроскопическим методом при малом увеличении не позднее чем через два часа после забора материала. Активность мерцательного эпителия считали нормальной, если по крайней мере на 50% внутренней поверхности кольца трахеи было заметно интенсивное движение ресничек эпителия. Каждая секция с нормальной активностью мерцательного эпителия получала оценку 0. Если активность мерцательного эпителия внутреннего кольца составляла менее 50%, секция получала оценку 1. Затем был рассчитан общий балл (от 0 до 10) для каждого цыпленка. Считали, что птица не поражена вирусом, если хотя бы в 9 из 10 колец выявлена нормальная активность мерцательного эпителия (общий балл ≤ 1).
Поскольку суточные цыплята слишком малы, чтобы выжить при кровотечении, по три цыпленка из тех же партий, из которых формировали группы, были усыплены и обескровлены непосредственно перед первой вакцинацией. При проведении в двухнедельном возрасте повторной вакцинации образцы крови цыплят брали непосредственно перед ней. У всей птицы (за исключением четвертого исследования, где 50% поголовья было обескровлено) пробы крови отбирали перед контрольным заражением и через пять дней после него (кроме третьего исследования). Все образцы сыворотки изучили методом твердофазного иммуноферментного анализа (ИФА, или ELISA) для определения количества антител к ИБК.
Уровень статистической значимости для результатов теста на цилиостаз (процентное соотношение защищенной птицы) и серологическую реакцию (процентное соотношение цыплят с положительной серологической реакцией) составлял 0,05. В ходе всех четырех исследований определили общий показатель цилиостаза для каждой особи, а затем рассчитали его среднее значение для каждой группы. Вычислили процент защищенной птицы в каждой группе и сравнили данные, полученные в контрольных и опытных группах. Для анализа в первом исследовании использовали попарное тестирование, а во втором исследовании — точный тест Фишера. В третьем и четвертом исследованиях применяли критерий Пирсона и точный тест Фишера. Когда ожидаемая частота в одной или нескольких ячейках факторной таблицы была меньше пяти, точный тест Фишера считали более подходящим, в противном случае выводы делали, опираясь на критерий Пирсона. При сравнении показателей групп вакцинированной и невакцинированной птицы применяли односторонние тесты, а при сравнении результатов различных схем вакцинации — двусторонние. Критерий Пирсона также использовали для сравнения данных третьего и четвертого исследований.
При визуальном осмотре птицы ни в одной из групп на протяжении всех исследований не отмечали таких клинических признаков, как кашель, чиханье или конъюнктивит.
Полученные результаты позволили выявить различия в показателях цилиостаза у вакцинированной и невакцинированной птицы после контрольного заражения штаммом 793B. По данным первого исследования, вакцина по своей эффективности соответствовала требованиям Европейской фармакопеи (не менее 80% невакцинированных особей не должны иметь иммунитета, тогда как в группе вакцинированной птицы он должен сформироваться не менее чем у 80% особей). Различия между показателями групп вакцинированных и невакцинированных цыплят были статистически значимыми (p < 0,05).
Результаты второго исследования показали, что иммунитет выработался более чем у 80% вакцинированной птицы. В контрольных группах количество незащищенных особей было меньше 80%. Возможно, это связано с разбавлением вируса до слишком низкого титра. Различия между данными опытных и контрольных групп оказались статистически значимыми (p < 0,05). При проведении третьего исследования статистически значимые различия выявлены между показателями двух групп птицы, привитой разными вакцинами, и группой непривитых цыплят после контрольного заражения штаммом израильского варианта 2 (p < 0,05). Уровень защиты, созданной путем введения цыплятам комбинированной вакцины на основе штаммов H120 и D274 в первые сутки жизни и QX-подобного штамма на 14‑й день, составил 70%. Применение вакцины, содержащей штамм IBMM 1263, в первые сутки и вакцины на основе QX-подобного штамма на 14‑й день обеспечило меньший уровень защиты — 50%. Разница между показателями птицы двух вакцинированных групп не была статистически значимой (p = 0,167). В четвертом исследовании отмечены статистически значимые различия между данными, полученными в группах привитой и непривитой птицы после контрольного заражения штаммом израильского варианта 2 (p < 0,05). При вакцинации препаратами на основе штаммов H120 и D274 в первые сутки жизни иммунитет сформировался у 61,1% цыплят.
При исследовании проб сыворотки крови, взятых у суточных цыплят, антител к ИБК не обнаружено. При проведении анализов после завершения программы вакцинации в ходе каждого исследования отмечали серологический ответ. При контрольном заражении профиль антител в сыворотке изменился у 15% вакцинированных цыплят в первом исследовании, у 40–50% — во втором, у 58,3–65,2% — в третьем и у 60% — в четвертом.
Различия в количестве образцов с положительной серологической реакцией, взятых у вакцинированной и невакцинированной птицы, на момент контрольного заражения были статистически значимыми, за исключением первого исследования. Пробы крови птицы контрольных групп имели отрицательную серологическую реакцию на протяжении всего периода исследований.
Более надежную защиту от заражения различными серотипами вируса ИБК обычно обеспечивает использование комбинированной программы вакцинации, включающей введение двух вакцин против ИБК, которые различаются по антигенным свойствам (Коок и др., 1999). Наиболее часто применяют вакцины на основе вирусов Массачусетского серотипа, таких как штаммы H120 и ММ, или двухвалентные вакцины, содержащие штаммы H120 и D274, ММ и Арканзас.
Тесты на цилиостаз, проведенные в рамках всех исследований, показали, что уровень защиты вакцинированной птицы был значительно более высоким, чем невакцинированной. Вероятно, защиту вакцинированных цыплят обеспечило формирование местного иммунитета в верхних дыхательных путях в результате введения живых вакцин. Применение теста на цилиостаз для оценки уровня перекрестной защиты предписано Европейской фармакопеей. Это информативный и широко используемый метод.
Результаты исследований показали, что иммунизация суточных цыплят вакцинами на основе штаммов H120 и D274 или штамма IBMM 1263 и ревакцинация препаратом, содержащим QX-подобный штамм, через 14 дней (второе исследование) так же, как и применение комбинированной вакцины, в состав которой входят штаммы H120 и D274, и вакцины на основе QX-подобного штамма в суточном возрасте (первое исследование), обеспечивает надежную защиту от заражения штаммом 793B. Отмечена лишь небольшая разница в количестве птицы, у которой сформировался иммунитет (83% в первом исследовании против 85% во втором). Как уже было сказано выше (Коок и др., 1999), при введении живых ослабленных вакцин, различающихся антигенно, перекрестный иммунитет сформировался у большего числа цыплят, чем при вакцинации этими препаратами в один день.
Контрольное заражение штаммом IS/1494/06 израильского варианта 2 после применения вакцины на основе штамма IBMM 1263 (Массачусетский серотип) в первые сутки жизни и ревакцинации через 14 дней вакциной, содержащей QX-подобный штамм, показало, что использование такой схемы обеспечило защиту не более 50% вакцинированной птицы. Однако бустер-иммунизация вакциной на основе QX-подобного штамма через 14 дней после вакцинации препаратом, содержащим штаммы H120 и D274, привела к увеличению доли защищенной птицы до 70%. Контрольное заражение штаммом израильского варианта 2 через 14 дней после введения вакцины на основе штаммов H120 и D274 позволило установить, что в этой группе иммунитет сформировался у 61% поголовья. Меньшая доля защищенной птицы (25%) выявлена после контрольного заражения вирусом израильского варианта 2 (IS/585/98) цыплят, которым ввели вакцину, содержащую штамм H120 (Гелб и др., 2005). Контрольное заражение вирусом израильского варианта 2 (например, D1344/2/4/10) птицы, вакцинированной препаратом на основе штамма H120 и ревакцинированной через 11 дней вакциной, в состав которой входит штамм, близкий по свойствам серотипу 793B, показало, что применение такой схемы обеспечивает защиту 30–40% поголовья (Татар-Кис и др., 2012).
Данные, полученные в результате исследований, подтверждают: сочетание вакцин H120 и D274 может повысить уровень защиты птицы.
Механизм формирования перекрестной защиты пока полностью не объяснен. Отмечена клеточно-опосредованная иммунная реакция после первичной вакцинации препаратом на основе штамма H120 (Тиммс, Брейсвил, 1981). Эта реакция была перекрестной (Дхинакар Р., Дхинакар Д., 1997). Доказано, что штамм Н обладает редкой способностью обеспечивать перекрестную защиту от гетерологичных серотипов вируса, а значит, есть вероятность, что его применение окажется эффективным для контроля распространения более широкого спектра серотипов (Бижленга и др., 2004). Обеспечение перекрестной защиты может быть обусловлено тем, что геном вируса по большей части остается неизменным до момента, пока не появляются совсем новые варианты, что позволяет им быть актуальными в плане протектотипа, даже если их серотип отличен от полевого штамма (Занаты и др., 2013).
С помощью ELISA определяли уровень антител к ИБК. ELISA — надежный и чувствительный метод мониторинга эффективности схем вакцинации, который позволяет быстро выявить первоначальное увеличение количества антител к ИБК (Хадакчи и др., 2005). Результаты этого анализа показывают, что после применения одной и той же схемы вакцинации в ходе разных исследований процент птицы с положительной серологической реакцией на момент контрольного заражения был неодинаковым. В двух группах, цыплят которых иммунизировали комбинированной вакциной на основе штаммов H120 и D274, а затем ревакцинировали препаратом, содержащим QX-подобный штамм, процент птицы с положительной серологической реакцией составил 40 и 65,2. После введения вакцины, в состав которой входил штамм IBMM 1263, в суточном возрасте и ревакцинации вакциной на основе QX-подобного штамма через 14 дней защищенных цыплят в группах оказалось соответственно 50 и 58,3%. Доля защищенной птицы после вакцинации препаратом, содержащим штаммы H120 и D274, достигала 60%.
Введение вакцины на основе штаммов H120 и D274, а также QX-подобного штамма суточным цыплятам дало самый низкий процент серопозитивных особей на момент контрольного заражения — 15. Различия в количестве особей с положительной серологической реакцией в группах вакцинированных и невакцинированных цыплят на момент контрольного заражения в ходе второго, третьего и четвертого исследований были статистически значимыми. Хотя после введения живых вакцин против ИБК гуморальный ответ обычно низкий или средний (Террегино и др., 2008), уровень антител к ИБК в крови птицы не всегда коррелирует с защитой (Рагги, Лии, 1965; Кавана, 2003), и результаты исследований, представленные в этой статье, подтверждают данную тенденцию. Следует также учитывать, что живые вакцины стимулируют местный, системный и клеточно-опосредованный иммунитет к ИБК (Бижленга и др., 2004).
Четыре описанных исследования проведены на цыплятах, свободных от специфических патогенов. Вполне вероятно, что в полевых условиях цыплята будут иметь материнские антитела. Установлено, что их присутствие в крови птицы не снижает эффективность использования живых вакцин против ИБК в первые сутки жизни (Давелаар, Коувенховен, 1977).
Исходя из полученных результатов можно сделать вывод: схема вакцинации, предполагающая введение комбинированной вакцины на основе штаммов H120 и D274 суточным цыплятам и повторную иммунизацию вакциной, содержащей QX-подобный штамм, через две недели, по‑видимому, обеспечивает более надежную защиту поголовья от заражения штаммом израильского варианта 2 (70%), чем от заражения штаммом IBMM 1263 (50%). Статистически значимые различия между показателями опытных и контрольной групп указывают на то, что в районах, где распространен штамм ИБК IS/1494/06 израильского варианта 2, применение вакцины на основе штаммов H120 и D274 в сочетании с вакциной, содержащей QX-подобный штамм, может помочь защитить птицу от этого вируса в полевых условиях.
Результаты контрольного заражения цыплят штаммом 793B показали, что уровень защиты поголовья (85%) был одинаковым при введении вакцины, содержащей штаммы H120 и D274, в первые сутки жизни и ревакцинации вакциной на основе QX-подобного штамма через 14 дней и при использовании вакцины на основе штамма IBMM 1263 в первые сутки с ревакцинацией препаратом, в состав которого входит QX-подобный штамм, через 14 дней. Уровень защиты после применения вакцины, содержащей штаммы H120 и D274, в сочетании с вакциной на основе QX-подобного штамма был примерно таким же (83%). Поэтому любую из этих схем вакцинации можно использовать в регионах, где распространен полевой вариантный штамм 793B. Необходимо идентифицировать штаммы ИБК, циркулирующие в определенной местности, поскольку только так можно выбрать эффективную схему вакцинации.
Представленные в статье и приведенные в научной литературе данные подтверждают, что применение определенных комбинаций вакцин против ИБК может обеспечить защиту птицы от вирулентного штамма, который генетически отличается от вакцинных штаммов. Это означает, что разработка новых вакцин на основе появляющихся штаммов не всегда необходима. Исследования эффективности формирования перекрестного иммунитета не требуют больших затрат времени. Если полученные результаты удовлетворительные, можно использовать доступные вакцины, а в дальнейшем при необходимости разработать препараты на основе новых штаммов.
Статья опубликована в журнале Avian Pathology в 2017 г. (T. Bru, R. Vila, M. Cabana, H.J. Geerligs)
ООО «Зоэтис»
123112, Москва, Пресненская наб., д. 10, блок С
Тел.: +7 (499) 922‑30‑22
Факс: +7 (499) 922‑30‑21
www.zoetis.ru