Сегодня наиболее распространенная бактерия, вызывающая заболевания у свиней, — Streptococcus suis, которая характеризуется большим разнообразием штаммов. Известно 35 различных серотипов, классифицированных по их капсульным полисахаридам. S. suis становится причиной развития у животных менингита, артрита, полисерозита, эндокардита, отита, бронхопневмонии, которые приводят к значительным экономическим потерям в свиноводстве.
Бактерия S. suis достаточно хорошо приспосабливается к защитным механизмам иммунной системы хозяина, колонизирует слизистые оболочки, надолго поселяется в верхних дыхательных путях и миндалинах. S. suis генетически и фенотипически относится к гетерогенному виду бактерий. Штаммы, принадлежащие к разным капсулярным серотипам или даже к одному и тому же серотипу, генетически отличаются друг от друга (Blume et al., 2009; Gottschalk et al., 2013). Это объясняет постоянное присутствие стрептококка как в организме отдельно взятых животных, так и в целом в стадах хозяйств с различной эпизоотической обстановкой, что приводит к их стационарному неблагополучию.
Поросята впервые сталкиваются с этим возбудителем, находясь еще в утробе свиноматки, затем во время рождения, проходя через родовые пути, и в постнатальный период — при потреблении молозива и молока, а также при скалывании клыков, купировании хвостов, кастрации и других ветеринарных манипуляциях. Около 98% поросят инфицируются стрептококком в период выращивания. Максимальное количество случаев проявления стрептококковой инфекции фиксируют в послеотъемный период, во время перегруппировок, в возрасте 35–60 дней, когда уровень материнских антител снижается, а также в период откорма. Однако стрептококковая инфекция может проявиться у животных любого возраста, в любой технологической группе, затронуть любой орган и любую ткань. S. suis поражает также крупный рогатый скот, овец, коз, лошадей, кошек, собак, других животных и птицу.
Индекс контагиозности S. suis равен 0,4, то есть в среднем заболевают 40 из 100 индивидуумов, тем или иным путем соприкасавшихся с больными и инфицированными животными. Степень тяжести болезни зависит от вирулентности бактерии, то есть от ее способности заражать организм.
У стрептококка много факторов вирулентности. Один из главных — М-протеин. Также в клеточной стенке этой бактерии имеются Т- и R-протеины. Стрептококки продуцируют токсины и ферменты. Эритрогенный токсин (токсин сыпи) обладает цитотоксическим, эритрогенным, симпатикотропным, аллергическим действием, стрептолизин S оказывает иммуносупрессивный эффект, стрептолизин О имеет кардиотропную активность, энтеротоксин вызывает диарею. Ферменты (гиалуронидаза, стрептокиназа, амилаза, липопротеиназа и др.) способствуют распространению инфекции в организме.
Недавнее исследование показало, что штаммы стрептококка серотипов 2 и 9 экспрессируют гены, кодирующие многомодальные белки адгезины, известные как антигены I/II (Ag I/II). В присутствии гликопротеинов слюны они приводят к агрегации S. suis, адгезии и колонизации верхних дыхательных путей свиней. На бактерии стрептококка в агрегированном состоянии не влияет кислотная среда желудка. Это приводит к дальнейшей колонизации ими кишечника (Chuzeville et al., 2017). S. suis также имеет адгезин, который обильно синтезируют бактерии, находящиеся в плазме крови. Он обусловливает устойчивость бактерий к механизмам иммунной защиты.
Как у большинства стрептококков, наиболее значимая антигенная структура S. suis — это полисахаридная капсула, которая определяет столь обширное разнообразие серогрупп и серотипов бактерии. Капсула покрывает всю поверхность бактериальной клетки, частично препятствуя ее адгезии к эпителиальным клеткам хозяина. Исследования показали, что подавление синтеза капсулы приводит к усилению взаимодействия адгезинов и облегчает прикрепление бактерий (Salasia et al., 1995; Lalonde et al., 2000; Benga et al., 2004; Esgleas et al., 2005). Толщина капсулы зависит от среды, окружающей бактерию, а также от ткани, в которой она находится. Установлено, что капсула тоньше при колонизации клеток дыхательного эпителия (Gottschalk and Segura, 2000). Кроме того, капсула препятствует адгезинам и гидрофобным компонентам клеточной стенки S. suis, ответственным за образование биопленки (Tanabe et al., 2010). В кровотоке капсула толще, и это позволяет S. suis избежать фагоцитоза. Также бактериальная капсула делает бактерии невосприимчивыми к воздействию антибиотиков (Smith et al., 1999; Gottschalk and Segura, 2000; Segura et al., 2004; Roy et al., 2016).
S. suis образует биопленки, объединяющие бактерии в так называемый информационно-биохимический кворум. Это сигнальная сеть, регулируемая геном luxS (кодирующий фермент S-рибозилгомоцистеиназа), который был обнаружен у вирулентных штаммов S. suis. Кроме того, муцин, продуцируемый бокаловидными клетками эпителия, может усиливать образование биопленок и способствовать выживанию бактерий даже при недостатке питательных веществ (Mothey et al., 2014). Известно, что вирулентные штаммы S. suis продуцируют биопленки лучше, чем авирулентные штаммы (Wang et al., 2011).
В течение пяти лет ученые компании «Консул» проводили бактериологическую диагностику с выделением чистых культур стрептококка, подвергали его ПЦР-детекции на основе определения генома, отвечающего за формирование капсульных особенностей, а также осуществляли серологический мониторинг. Результаты исследований легли в основу нашей работы по созданию вакцины против стрептококкоза свиней — СтрептоВаК-С.
Известно, что естественный резервуар стрептококка — свиньи и дикие кабаны. Однако не стоит забывать и о носительстве бактерии среди людей. Субклиническое течение инфекции — ключевая причина закрепления и распространения стрептококка в популяции восприимчивых животных. Это имеет большое значение как для эпизоотологии, так и для эпидемиологии.
Как факультативно-патогенная бактерия, S. suis вызывает болезнь различной силы и степени клинического проявления в зависимости от тех или иных факторов. Важную роль играют технология и условия содержания (скученность животных, частые перегруппировки, микроклимат, санитарное состояние и др.). Имеет значение и наличие в стаде циркулирующих вирусов, вызывающих сильную иммуносупрессию.Именно поэтому наиболее восприимчивы к стрептококку поросята-отъемыши и подсвинки.
К возрасту 35–40 дней у молодняка полностью истощается запас материнских антител, в то время как адаптивный иммунный ответ еще не сформирован. Ситуация осложняется тем, что в период отъема поросят их дыхательные пути заселяют патогенная микрофлора и другие бактерии, такие как Haemophilus parasuis, Mycoplasma hyopneumoniae, Actinobacillus pleuropneumoniae, Actinobacillus suis, Pasteurella multocida, Bordetella bronchiseptica.
В сумме все эти факторы приводят к развитию у поросят бронхолегочных заболеваний, достаточно трудно поддающихся лечению. Прежде всего это вирусно-бактериальные коинфекции: РРСС, классическая чума свиней, цирковирусы PCV2, PCV3 и S. suis, а на более поздних сроках откорма болезни вызывают A. pleuropneumoniae, A. suis.
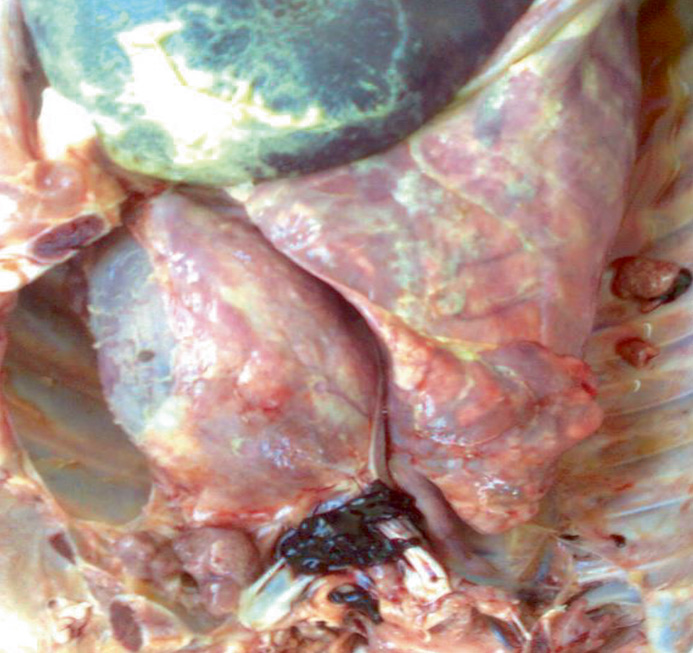
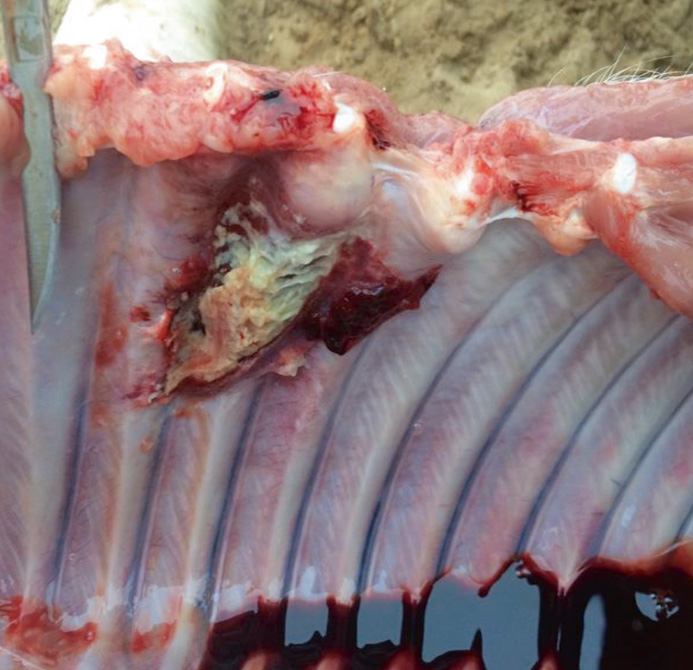
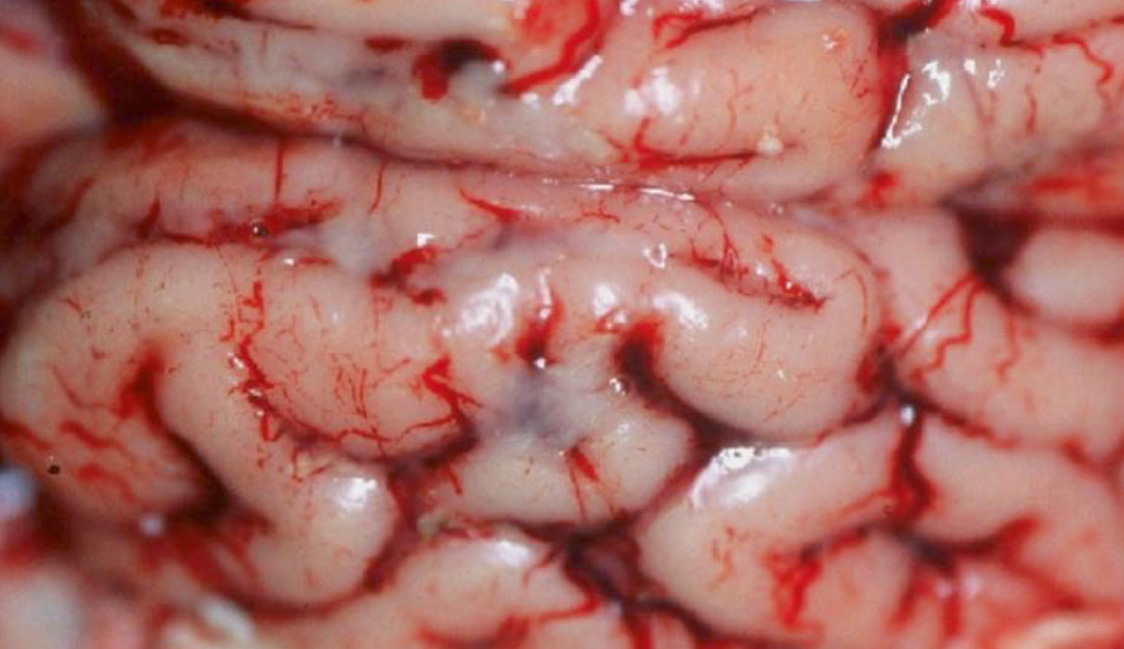
На протяжении нескольких лет мы вели наблюдение и сбор данных о причинах непроизводительного выбытия поросят в хозяйстве. На фото представлены патолого-анатомические изменения их внутренних органов (легкие, сердце, головной мозг). Отметим, что патолого-анатомические изменения зависят прежде всего от стадии и продолжительности инфекционного процесса. На фото виден выраженный хронический воспалительный процесс, характеризующийся крупозной и катарально-фибринозной пневмонией, плевритом и перикардитом. Также заметны кровоизлияния в оболочке головного мозга (фото 1–5).
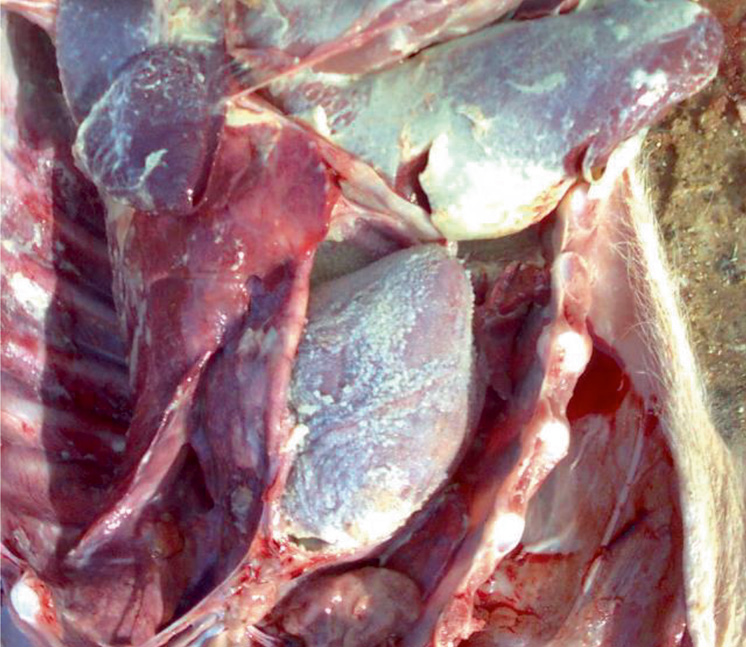
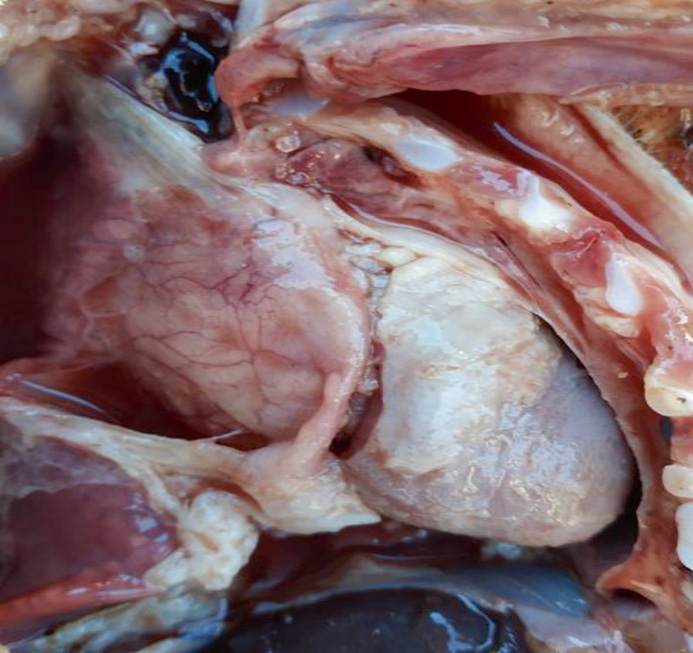
При бактериологическом и вирусологическом исследованиях патологического материала поросят были выделены Streptococcus suis, Streptococcus spp., Staphylococcus spp., Enterococcus spp., единичные Escherichia coli. При применении метода полимеразной цепной реакции выявлен геном S. suis (серотипы 2, 3, 7, 12, 16, 18, 24, 29, 30, 31). В кусочках органов (селезенка) и в сыворотке крови подсвинков в возрасте 40 дней выявлен геном вируса РРСС.
Наши исследования показали, что при воздействии иммуносупрессивных вирусов происходит значительное подавление фагоцитарной активности дендритных клеток и макрофагов, а также торможение антигенпрезентирующей функции плазматических клеток, Т- и В-лимфоцитов, что приводит к клиническому проявлению стрептококковой инфекции, вызванной S. suis. Установлено, что под воздействием вируса РРСС у поросят в период с 40‑го по 80‑й день жизни существенно угнетается синтез GM-CSF, IFN-γ, IL-1, IL-6, IL-18. При развитии инфекции и ослаблении иммунитета происходит резкое увеличение уровня IL-8 (+ 1319%) и кахексина (TNF-α), а также снижение уровня IL-10 (– 51%). Высокое содержание в крови кахексина вызывает воспаление, которое в дальнейшем приводит к истощению животных.
Также мы изучили уровень иммуноглобулинов (IgG) к вирусу РРСС и S. suis до и после применения вакцины СтрептоВаК-С и вакцины против РРСС. Установлено, что на фоне вакцинации поросят происходит поэтапная стабилизация серологического профиля в отношении РРСС и вытеснение S. suis из стада, что подтверждено результатами исследования микробиологическим методом и методом ПЦР. Этиологический агент был купирован.
Проведенная нами работа показала, что длительное применение антибиотиков любого вида не приводит к прекращению циркуляции S. suis в поголовье свиней. Стрептококки и сегодня остаются наиболее распространенными в свиноводстве бактериальными патогенами. В хозяйстве, где проходил опыт, наблюдалось стационарное неблагополучие по S. suis. Разнообразие серотипов, а также значительные антигенные различия стрептококков осложняют выработку стратегий профилактики болезни и сдерживания ее распространения. В ходе эволюции бактерия S. suis приобрела резистентность к антибиотикам и устойчивость к механизмам иммунной защиты. Применение интенсивной схемы вакцинации маточного поголовья и поросят вакциной СтрептоВаК-С позволило купировать распространение и негативное влияние S. suis вплоть до полного прекращения циркуляции бактерии в хозяйстве.
Результаты исследования клеточного иммунитета (цитокиновый профиль) поросят указывают на активные воспалительные процессы в бронхолегочной ткани и в сердце, приводящие к кахексии поросят, обусловленной ассоциативными коинфекциями преимущественно вирусно-бактериальной этиологии (вирус РРСС и S. suis). К сожалению, на рынке стран СНГ нет зарегистрированных вакцин, в состав которых входят аттенуированные вирусы РРСС типа 1 подтипов 2 и 3. Выявленный и генотипированный нами вирус РРСС, циркулирующий в исследуемом хозяйстве, наиболее близок к штаммам SU1‑Bel, lena genotype 1, subtype 3. Степень гомологии составляет 94,76%. Реализация программы вакцинации с применением вакцины против РРСС позволила купировать острую фазу его клинического проявления, снизив циркуляцию высокопатогенного полевого вируса в хозяйстве. Безусловно, полностью он не уничтожен, поэтому без выполнения обязательных мероприятий по контролю распространения полевого вируса РРСС всегда остается риск повторной вспышки болезни.
Результаты оценки уровня IgG методом ELISA, полное отсутствие клинических проявлений и патолого-анатомических признаков заболевания, а также данные бактериологического исследования, которое не выявило циркулировавшей ранее коинфекции РРСС + S. suis, позволяют сделать вывод о том, что вакцинация остается самым действенным методом профилактики болезней, вызванных стрептококком.
Авторы благодарят Наталью Лемиш, Сергея Герасимчука, Александра Пономарёва, Геннадия Сергеева, Артёма Пулиша, Михаила Чиртика за помощь в работе над статьей.
ООО «Агро-Фуд РТФ»
105264, Москва, ул. 9‑я Парковая, д. 37, 2‑й этаж, офис 2
Тел.: +7 (499) 464‑69‑56, (495) 965‑98‑95
agro-food@mail.ru
www.agro-food.ru